 |
Окислительно-восстановительных реакций
|
|
|
|
Распространенные окислители и их продукты
| Окислитель | Полуреакции | Продукт | Стандартный потенциал, В |
| O2 кислород | 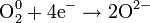
| Разные, включая оксиды, H2O и CO2 | +1,229 (в кислой среде) +0,401 (в щелочной среде) |
| O3 озон | Разные, включая кетоны и альдегиды | ||
| Пероксиды | 
| Разные, включая оксиды, окисляет сульфиды металлов до сульфатов H2O | |
| Hal2 галогены | 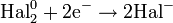
| Hal−; окисляет металлы, P, C, S, Si до галогенидов | F2: +2,87 Cl2: +1,36 Br2: +1,04 I2: +0,536 |
| ClO− гипохлориты | Cl− | ||
| ClO3− хлораты | Cl− | ||
| HNO3 азотная кислота | с активными металлами, разбавленная
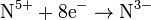 с активными металлами, концентрированная
с активными металлами, концентрированная
 с тяжёлыми металлами, разбавленная
с тяжёлыми металлами, разбавленная
 c тяжёлыми металлами, концентрированная
c тяжёлыми металлами, концентрированная
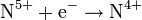
| NH3, NH4+ NO NO NO2 | |
| H2SO4, конц. серная кислота | c неметаллами и тяжёлыми металлами
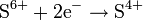 с активными металлами
с активными металлами
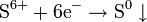
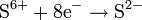
| SO2; окисляет металлы до сульфатов с выделением сернистого газа или серы S H2S | |
| Шестивалентный хром | 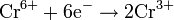
| Cr3+ | +1,33 |
| MnO2 оксид марганца(IV) | 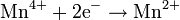
| Mn2+ | +1,23 |
| MnO4− перманганаты | кислая среда
 нейтральная среда
нейтральная среда
 сильнощелочная среда
сильнощелочная среда

| Mn2+ MnO2 MnO42− | +1,51 +1,695 +0,564 |
| Катионы металлов и H+ | 
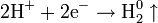
| Me0 H2 | см. Электрохимический ряд активности металлов |
- частицы (атом, молекула или ион), отдающие электроны, называются восстановителями.
Восстановителями могут быть:
1. Нейтральные атомы металлов и некоторые неметаллы (Znо, Mgо, Cо и др.)
2. Отрицательно заряженные ионы неметаллов (S-2, J-,…);
3. Положительно заряженные ионы металлов с низшей степенью окисления (Sn+2,Pb+2);
4. Сложные кислородосодержащие ионы с низшей степенью окисления (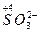 ,
, 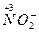 );
);
5. Катод.
Наиболее употребляемыми восстановителями на практике являются: C, CO, H2 , Zn, Ca, Mg, Al, Fe, H2S, Na, Na2S, Na2S2O3, HI, KI, HBr, HCl, SnCl2, NH3, альдегиды, спирты, муравьиная и щавелевая кислоты, глюкоза.
|
|
|
Важнейшие восстановители и окислители
| Восстановители | Окислители |
| Металлы, водород, уголь. Окись углерода (II) (CO). Сероводород (H2S); оксид серы (IV) (SO2); сернистая кислота H2SO3 и ее соли. Галогеноводородные кислоты и их соли. Катионы металлов в низших степенях окисления: SnCl2, FeCl2, MnSO4, Cr2(SO4)3. Азотистая кислота HNO2; аммиак NH3; гидразин NH2NH2; оксид азота(II) (NO). Катод при электролизе. | Галогены. Перманганат калия(KMnO4); манганат калия (K2MnO4); оксид марганца (IV) (MnO2). Дихромат калия (K2Cr2O7); хромат калия (K2CrO4). Азотная кислота (HNO3). Серная кислота (H2SO4) конц. Оксид меди(II) (CuO); оксид свинца(IV) (PbO2); оксид серебра (Ag2O); пероксид водорода (H2O2). Хлорид железа(III) (FeCl3). Бертоллетова соль (KClO3). Анод при электролизе. |
Мнемонические правила для запоминания процессов окисления-восстановления, а также свойств окислителей и восстановителей:
1. Отдать — Окислиться, Взять — В осстановиться.
2. Окислитель — это грабитель (в процессе окислительно-восстановительной реакции окислитель присоединяет электроны). Восстановитель — это тот, кто электроны отдает. Отдает грабителю, злодею-окислителю.
3. ПВО — Присоединяет (электроны), Восстанавливается, является Окислителем.
4. Отдает — окисляется, сам Восстановителем является.
Окислительно-восстановительные реакции представляют собой диалектическое единство одновременно протекающих двух противоположных процессов – окисления и восстановления. В этих реакциях число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем. При этом независимо от того, переходят ли электроны с одного атома на другой полностью или лишь частично оттягиваются к одному из атомов, условно говорят только об отдаче и присоединении электронов.
Методы составления уравнений
окислительно-восстановительных реакций
|
|
|
При составлении уравнений ОВР, для удобства, в исходных веществах вначале ставят записывать восстановитель, затем окислитель и среду (если это необходимо); в продуктах реакции – продукты окисления, затем восстановления и другие вещества. Применяются два метода составления ОВР: электронного баланса и полуреакций (ионно-электронный метод).
Метод электронного баланса. Рассмотрим следующую реакцию
Na2SO3 + KMnO4+ H2SO4 = Na2SO4 + K2SO4 + MnSO4 + H2O.
Определяют окислительные числа элементов до и после реакции
+1 +4 –2 +1+7 -2 +1+6-2 +1+6-2 +1+6-2 +2+6-2 +1-2
Na2SO3 + KMnO4 + H2SO4 = Na2SO4 + K2SO4 + MnSO4+H2O
Находят окислитель и восстановитель. Ион серы (S+4) в Na2SO3повышает свою степень окисления, то есть теряет электроны, является восстановителем и в процессе реакции окисляется. Ион марганца (Mn+7) в KMnO4 понижает свою степень окисления, то есть присоединяет электроны, является окислителем и в процессе реакции восстанавливается, следовательно, в этой реакции Na2SO3 – восстановитель, KMnO4 – окислитель.
Записывают в левой части начальное состояние серы и марганца, а в правой – конечное и определяют количество потерянных S+4 и принятых Mn+7 электронов
S4+ – 2e = S6+
Mn7+ + 5e = Mn2+
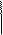
 Составляют электронный баланс, то есть общее число электронов, отданных восстановителем, должно быть равно общему числу электронов принятых окислителем. Определяют общее количество отданных и принятых электронов (общее наименьшее кратное). Оно равно 10. Следовательно, 10 электронов теряют 5 ионов серы и присоединяют 2 иона марганца
Составляют электронный баланс, то есть общее число электронов, отданных восстановителем, должно быть равно общему числу электронов принятых окислителем. Определяют общее количество отданных и принятых электронов (общее наименьшее кратное). Оно равно 10. Следовательно, 10 электронов теряют 5 ионов серы и присоединяют 2 иона марганца
S4+ – 2e = S6+ 2 5
Mn7+ + 5e = Mn2+ 5 2
Переносят эти коэффициенты в уравнение реакции
5Na2SO3 + 2KMnO4 + H2SO4 = 5Na2SO4 + K2SO4 + 2MnSO4 + H2O
Определяют число молекул H2SO4, участвующих в реакции образования двух молекул MnSO4 и молекулы K2SO4, и оно равно трем
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + K2SO4 + 2MnSO4 + H2O
По количеству атомов водорода в серной кислоте определяют число молекул воды
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + K2SO4 + 2MnSO4 +3H2O
Правильность расстановки коэффициентов проверяют по числу атомов кислорода в левой и правой частях уравнения.
Метод полуреакций. Как показывает название, этот метод предусматривает раздельное составление ионных реакций для процесса окисления и процесса восстановления с последующим суммированием их в общее ионное уравнение. При этом сильные электролиты записывают в виде ионов, а слабые электролиты записывают в виде молекул.
|
|
|
В ионную схему включают те частицы, которые подвергаются изменению, то есть проявляют восстановительные или окислительные свойства, а также частицы, характеризующие среду: кислую – ион H+ , щелочную – OH- и нейтральную – H2O. Этот метод удобно использовать в том случае, когда реакция протекает в растворе или расплаве. Поэтому в электронно-ионном методе записывают реально существующие ионы
 .
.
Пример 1. Составить уравнение реакции взаимодействия KNO2 с K2Cr2O7 в кислой среде, используя метод полуреакций. Определяют окислитель и восстановитель. Окислителем в этой реакции является ион 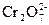 . В кислой среде он принимает 6 электронов и образует 2 иона Сr3+, а освободившийся кислород вместе с ионом H+ среды образует молекулы воды
. В кислой среде он принимает 6 электронов и образует 2 иона Сr3+, а освободившийся кислород вместе с ионом H+ среды образует молекулы воды
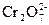 + 14H+ + 6e = 2Cr3+ + 7H2O.
+ 14H+ + 6e = 2Cr3+ + 7H2O.
Это уравнение первой полуреакции – восстановление окислителя. Восстановителем является ион 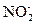 . Он отдает два электрона и окисляется до иона
. Он отдает два электрона и окисляется до иона  Получающийся в ходе реакции ион
Получающийся в ходе реакции ион  содержит больше кислорода, чем ион
содержит больше кислорода, чем ион 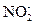 . Недостающее количество кислорода пополняется за счёт молекулы воды, при этом освобождается 2Н+ -иона
. Недостающее количество кислорода пополняется за счёт молекулы воды, при этом освобождается 2Н+ -иона
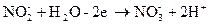 .
.
Общее число электронов, отдаваемых восстановителем и присоединяемых окислителем, должно быть равным. В нашем примере оно равно 6. Отсюда, записав уравнения обеих полуреакций, находят коэффициенты для окислителя и восстановителя

Суммируют электронно-ионные уравнения (предварительно умноженные на коэффициенты)
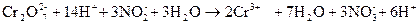
Сокращают подобные члены и составляют сокращенное ионное уравнение
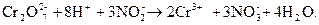
Поэтому ионному уравнению составляют молекулярное уравнение, для чего каждому аниону приписывают соответствующий катион, а каждому катиону – соответствующий анион. И, как правило, сначала записывают формулы молекул восстановителя, затем – окислителя и среды
3KNO2 + K2Cr2O7 + 4H2SO4= 3KNO3 + Cr2(SO4)3 + K2SO4 + 4H2O.
При составлении уравнений методом полуреакций следует учитывать следующие факторы:
а) записывать в ионном виде восстановитель, окислитель и продукты их взаимодействия, а затем уже приступать к составлению уравнений полуреакций. Сильные электролиты записывают в виде ионов, а слабые электролиты, газы и вещества, выпадающие в виде осадков, в виде молекул. Продукты реакции (взаимодействия восстановителя и окислителя) устанавливаются опытным путём на основании известных свойств элементов;
|
|
|
б) если исходное вещество содержит больше кислорода, чем продукт реакции, то освобождающийся кислород в форме О2- связывается в кислых растворах ионами Н+ в воду, а в нейтральных растворах – в гидроксид-ионы
О2- + 2Н+ = Н2О или О2- + Н2О = 2ОН-;
в) если же исходное вещество содержит меньше атомов кислорода, чем продукты реакций, то недостаток их восполняется в кислых и нейтральных растворах за счёт молекул воды
Н2О = О2- + 2Н+,
а в щелочных – за счёт гидроксид-ионов
2ОН– = О2- + Н2О;
г) суммарное число и знак электрических зарядов слева и справа от знака равенства должны быть равны.
Достоинство метода полуреакций по сравнению с методом электронного баланса в том, что в нем используются реально существующие, а не гипотетические ионы. В самом деле, в растворе нет ионов Мn+7, Cr+6, S+6, а есть ионы 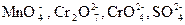 .
.
При этом не нужно определять степени окисления атомов, а также видна роль среды как активного участника процесса. Наконец, при использовании метода полуреакций не нужно знать все образующиеся вещества: они определяются в уравнении реакции при его выводе.
Следует отдавать предпочтение методу полуреакций и применять его при составлении уравнений всех окислительно-восстановительных реакций, которые протекают в водных растворах и расплавах.
|
|
|


