 |
Графический метод изображения процесса окисления — восстановления
|
|
|
|
Подобно тому, как процессы кислотно-основного титрования могут быть представлены графически в виде кривой титрования, изображающей изменение величины рН титруемого раствора по мере приливания к нему стандартного (титрованного) раствора кислоты или щелочи, процессы окислительно-восстановительного титрования можно также представить графически в виде кривой титрования, изображающей изменение окислительно-восстановительного потенциала Е титруемого раствора по мере приливания к нему стандартного (титрованного) раствора окислителя или восстановителя.
Каждый процесс окисления—восстановления характеризуется своей кривой титрования, изображающей изменение окислительно-восстановительного потенциала в процессе титрования. Как видно из уравнения:

величина потенциала Е зависит от величины нормального окислительно-восстановительного потенциала данной системы Е ° и от количественного соотношения концентраций окислителя и восстановителя. Например, потенциал раствора, содержащего одновременно соли двух- и трехвалентного железа, будет тем выше, чем больше отношение
| [Fe3+] (окислитель) |
| [Fe2+] (восстановитель) |
При титровании железа (II) перманганатом в кислой среде, согласно схеме
 Fe2+ Fe2+
| KMnO4 | Fe3+ |
[Fe3+] увеличивается по мере приливания титранта и одновременно уменьшается [Fе2+]. Следовательно, изменяется отношение [Fe3+]/[Fe2+]. По мере увеличения этого отношения окислительно-восстановительный потенциал тоже увеличивается.
Это постепенное увеличение потенциала происходит неравномерно. Вблизи точки эквивалентности наблюдается наиболее резкое (скачкообразное) изменение потенциала, объясняемое более резким изменением соотношения [Fe3+]/[Fe2+], которое достигает превышения начального отношения в миллион раз.
|
|
|
По величине нормальных потенциалов можно рассчитать величину константы равновесия данной окислительно-восстановительной реакции, а зная ее величину, можно вычислить отношение равновесных концентрации и рассчитать значение потенциалов в процессе титрования. В точке эквивалентности раствор характеризуется определенным окислительно-восстановительным потенциалом. Конец титрования может быть определен при помощи индикатора, изменяющего свою окраску при этом окислительно-восстановительном потенциале.
Изменение окислительно-восстановительного потенциала раствора в процессе титрования. Если опустить в раствор, содержащий Fe3+ и Fе2+-ионы, пластинку из инертного металла (например, платины) и соединить такой электрод с каким-либо другим окислительно-восстановительным (или ред-окс) электродом, то образуется гальванический элемент. При этом происходит окисление Fе2+ в Fе3+ или восстановление Fе3+ в Fе2+.
Окисление Fе2+ в Fе3+ происходит в том случае, когда второй электрод в гальваническом элементе является положительным, т. е. когда в реакцию вступает более сильный окислитель, чем Fе3+. Восстановление Fе3+ в Fе2+ наблюдается тогда, когда указанный электрод является отрицательным, т. е. когда в реакцию вступает более сильный восстановитель, чем Fе2+.
Таким образом, непременным условием протекания какой-либо окислительно-восстановительной реакции является наличие системы двух пар окислителей Окисл.1 и Окисл.2 и восстановителей — Восст.1 и Восст.2.
В начале титрования, когда имеется избыток восстановителя, величину окислительно-восстановительного потенциала, меняющуюся по мере изменения концентрации, вычисляют по формуле:
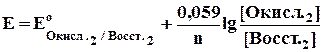
где [0кисл.2] и [Восст.2] относятся к титруемому веществу (восстановителю). В точке эквивалентности потенциал раствора вычисляют на основании величины нормальных потенциалов восстановителя и окислителя и константы равновесия данной реакции. После точки эквивалентности величину потенциала определяют по избытку прибавляемого окислителя по формуле:
|
|
|

где [0кисл.1] и [Восст.1] относятся к титрованному раствору (окислителю). При титровании окислителя восстановителем вычисления проводят аналогично.
Рассмотрим в качестве примеров титрование ионов железа(II) сульфатом церия(IV) и титрование ионов железа(II) перманганатом калия в сернокислой среде.
|
|
|


