 |
Эффективность теплового двигателя Эффективность теплового двигателя, действующего между двумя энергетическими уровнями , определена в пересчете на абсолютные температуры
|
|
|
|
η = (Th - Tc) / Th = 1 - Tc / Th где
η = эффективность
Th = верхняя граница температуры (K)
Tc = нижняя граница температуры (K)
Для того, чтобы достичь максимальной эффективности Tc должна быть на столько низкой, на сколько это возможно. Чтобы эффект был 100% -м, Tc должна равнятся 0 по шкале Kельвина. Практически это невозможно, поэтому эффективность всегда меньше 1 (менее 100%).
- Изменение энтропии > 0
Необратимый процесс - Изменение энтропии= 0
Двусторонний процесс (обратимый) - Изменение энтропии < 0
Невозможный процесс (неосуществимый)
Энтропия определяет относительную способность одной системы влиять на другую. Когда энергия двигается к нижнему энергетическому уровню, где уменьшается возможность влияния на окружающую среду, энтропия увеличивается.
Определение энтропии Энтропия определяется как:S = H / Tгде
S = энтропия (кДж/кг*К)
H = энтальпия (кДж/кг)
T = абсолютная температура (K)
Третий закон термодинамики • Формулировка: • При температуре абсолютного нуля (T = 0 K) все идеальные кристаллические вещества имеют одинаковую энтропию, равную нулю. • Третий закон термодинамики находится в согласии с формулой Больцмана (S = k·lnW), так как для идеального кристалла при абсолютном нуле W = 1, следовательно S = k·lnW = k·ln1 = 0; S = 0. • Третий закон термодинамики используется для вычисления абсолютных энтропий веществ при любой температуре T. Абсолютная энтропия. Стандартная энтропия • Энтропия любого химического соединения при абсолютном нуле температуры является нулевой и может быть принята за начало отсчёта при определении абсолютного значения энтропии вещества при любой температуре. • Абсолютное значение энтропии вещества в стандартном состоянии (T = 298K, p = 1 атм, n = 1 моль) – стандартная энтропия вещества. •Рассчитаем изменение энтропии некоторого вещества при нагревании от абсолютного нуля до температуры T при постоянном давлении. •Для расчёта абсолютной энтропии веществ надо знать зависимость Cp от T для каждой из фаз, а также температуры и энтальпии фазовых переходов.
|
|
|
2) Расчет площади камеры по заданной емкости. 
Расчет площади камер производится по заданной их емкости и допускаемой нагрузке на 1 м. Р — коэффициент увеличения площади, учитывающий размещение холодильного оборудования, отступы от стен и холодильного оборудования, рабочие проходы.
При приближенных расчетах для холодильников продовольственных магазинов расчет площади камер может быть произведен исходя из норм площади на одно рабочее место. Примерные нормы в зависимости от вида продуктов и размеров их реализации приведены в табл. 23. В табл. 24 приведены данные об условиях хранения продуктов в холодильниках торговых предприятий. Для типовых предприятий общественного питания площади камер можно принимать по нормам площадей, рекомендованным Гипроторгом (табл. 25). Для расчета емкости камер принимают сроки хранения для охлажденного мяса 3—5 суток, для мороженого 20—25 суток. ]
Пропускную способность рыбных морозилок рассчитывают по максимальному суточному поступлению рыбы в период наибольшего лова.
Емкость камер для хранения мороженой рыбы принимают в 20—30 раз больше пропускной способности морозилок. В холодильниках для птицы морозилки рассчитывают по максимальному суточном убою птицы, а камеры хранения на 6—10 суток хранения.
3) Экстра́кция (от лат. extraho — извлекаю) — метод извлечения вещества из раствора или сухой смеси с помощью подходящего растворителя (экстраге́нта). Для извлечения из смеси применяются растворители, не смешивающиеся с этой смесью. Экстракция может быть разовой (однократной или многократной) или непрерывной (перколя́ция).
|
|
|
Простейший способ экстракции из раствора — однократная или многократная промывка экстрагентом в делительной воронке. Делительная воронка представляет собой сосуд с пробкой и краном для слива нижнего слоя жидкости. Для непрерывной экстракции используются специальные аппараты — экстракторы, или перколяторы.Для извлечения индивидуального вещества или определённой смеси (экстракта) из сухих продуктов в лабораториях широко применяется непрерывная экстракция поСокслету.В лабораторной практике химического синтеза экстракция может применяться для выделения чистого вещества из реакционной смеси или для непрерывного удаления одного из продуктов реакции из реакционной смеси в ходе синтеза.
Экстракция применяется в химической, нефтеперерабатывающей, пищевой, металлургической, фармацевтической и других отраслях, в аналитической химии ихимическом синтезе. Жидкостная экстракция предполагает перенос одного (или больше) растворимых веществ, содержащихся в подаваемом растворе, в другую несмешиваемую жидкость (экстрагент). Экстрагент, обогащенный растворимыми веществами, называется экстракт. Остаток исходного раствора без растворимых веществ называется рафинат. Исходный раствор и экстрагент контактируют друг с другом для того, чтобы осуществился перенос растворимых веществ. Две выходящие жидкие фазы, экстракт и рафинат, разделяются статической декантацией (смеситель-отстойник) или центробежной декантацией (центробежные экстракторы).
Использование в промышленности]
Практическая экстракция проводится в:
· экстракционнoй колонне
· смесителе-отстойнике
· центробежном экстракторе
Растворитель подбирается отдельно к каждой обработке, в зависимости от компонентов входящего раствора. В зависимости от выбора растворителя и его количества, необходимого для качественного массообмена, для достижения желаемых результатов обработки, часто возникает необходимость проводить несколько этапов экстракции. В этом случае наиболее эффективным методом является противоточная экстракция.
Билет№12
Эксплуатация холодильной установки невозможна без правильного понимания термодинамических процессов, происходящих в ней. Изучение отдельных процессов, входящих в цикл паровой компрессионной машины, а также связи между ними, их взаимного влияния друг на друга может быть значительно упрощено при использовании термодинамических диаграмм холодильных агентов. Умение пользоваться диаграммами необходимо также для контроля и анализа параметров действующих холодильных установок; настройки приборов автоматического контроля и регулирования; расчета и подбора холодильного оборудования при реконструкции и расширении действующих установок.
|
|
|
Для каждого холодильного агента существуют свои диаграммы, но принцип их построения и пользования ими одинаков. На рис. 53, 54, 55 приведены диаграммы для аммиака и хладонов R-12 и R-22. Наиболее часто применяемыми являются диаграмма энтальпия-давление (l — lgP диаграмма) и диаграмма энтропия-температура (S — T диаграмма), из которых диаграмма энтальпия-давление наиболее удобна, и именно она будет рассматриваться в дальнейшем.образом, в холодильной машине происходят два процесса фазового перехода хладагента: из жидкости в пар — кипение и из пара в жидкость — конденсация. Эти два процесса и отражены на всех диаграммах. На рис. 56-а показано, что диаграмма разделена на три зоны, отделенные друг от друга кривыми насыщенной жидкости и насыщенного пара.
Зона переохлажденной жидкости означает, что в любой точке этой зоны хладагент находится в жидком состоянии при температуре ниже температуры насыщения при соответствующем давлении. Зона влажного пара соответствует процессам перехода из жидкости в пар или из пара в жидкость. В любом случае хладагент представлен в виде парожидкостной смеси, называемой влажным паром. Таким образом, влажный пар — это смесь насыщенной жидкости и насыщенного пара, которая находится либо в состоянии кипения, либо в состоянии конденсации. Температура смеси насыщенных пара и жидкости одинакова и называется температурой насыщения при определенном давлении насыщения.
Фазовый переход от жидкости к пару на диаграмме проходит слева направо, а из пара в жидкость — справа налево. Содержание (долю) пара в парожидкостной смеси отражают линии постоянного паросодержания — х. Они показывают массовую долю пара в парожидкостной смеси в долях единицы (рис. 56-б). На линии насыщенной жидкости паро-содержание х = 0, на линии насыщенного пара х = 1, в области влажного пара 1>x>0.
Зона перегретого пара отражает состояние пара, температура которого выше температуры насыщения при соответствующем Р. На пограничных кривых насыщенных жидкости или пара хладагент имеет параметры насыщения, но при этом представляет собой уже однородную фазу, т. е. либо жидкость, либо пар. При эксплуатации очень важно отличать по показаниям контрольно-измерительных приборов переохлажденную жидкость от насыщенной, а перегретый пар — от влажного или насыщенного пара, так как от этого зависят эффективность и безопасность работы установки. При одном и том же P насыщенная жидкость, влажный пар и насыщенный пар имеют одинаковую t, переохлажденная жидкость — более низкую, а перегретый пар — более высокую t. Таким образом, показания манометров при всех перечисленных состояниях будут одинаковые, а термометров — разные.
|
|
|
Диаграмма энтальпия-давление отражает шесть параметров холодильного агента, которые изображены в виде различных линий (рис. 56, б). Цифровые значения основных параметров даны в удельных величинах, т. е. отнесенные к 1 кг хладагента, и проставлены на поле диаграммы над соответствующими кривыми. 
2) Теплоприток через ограждающие конструкции определяется как сумма теплопритоков (через стены, перегородки, покрытия, полы), вызванных наличием разности температур снаружи ограждения и внутри охлаждаемого помещения, а также теплопритоков за счет воздействия солнечной радиации через покрытия и наружные стены.Теплопритоки через стены, перегородки, покрытия Q1 рассчитывают по формуле:

где Кд. – действительный коэффициент теплопередачи ограждения, определенный при расчете толщины изоляционного слоя, Вт/(м2·К);
F – площадь поверхности ограждения, м2;
tн – температура снаружи ограждения, °С;
tв – температура воздуха внутри охлаждаемого помещения, °С;
Δtc – избыточная разность температур, характеризующая действие солнечной радиации в летнее время, °С.
Для определения площади поверхности стен принимают:
1. длину наружных стен – между осями внутренних стен или от наружной поверхности наружных стен до оси внутренних.
2. длину внутренних стен – между внутренней поверхностью наружной стены и осью внутренней или между осями внутренних стен.
|
|
|
3. высоту стен – от уровня чистого пола до верха засыпки покрытия.
Площадь потолка и пола определяют как произведение длины камеры на ширину, которые измеряются между осями внутренних стен или от внутренней поверхности наружных стен до оси внутренних. Таким образом получаем следующие площади стен, пола и покрытия:
1) стена наружная северная

2) стена наружная западная

3) стена, выходящая в коридор

4) пол и покрытие

Температуру воздуха внутри охлаждаемого помещения принимаем по табл. tв = -18°С. Расчетную температуру наружного воздуха принимаем по табл. 1.1 [2] для летнего периода времени в г. Вологда tн = +28°С. Количество солнечной радиации зависит от зоны расположения холодильника (географической широты), характера поверхности и ориентировки ее по сторонам света. По табл. 3.1 [2] принимаем избыточную разность температур:
ü для наружной северной стены Δtc = 0°С.
ü для наружной западной стены (покрыта штукатуркой с окраской в темные тона) Δtc = 10,2°С.
ü для покрытия Δtc = 18,5°С.
ü для полов и внутренних стен этот вид теплопритока не учитывается.
Определив все неизвестные величины, рассчитаем теплоприток для каждого вида ограждения:
1) для северной наружной стены

2) для западной наружной стены

3) для внутренней стены с коридором

4) для внутренней стены, разделяющей камеры

5) для покрытия
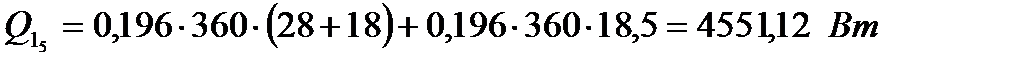
6) для пола

Все составляющие теплопритока от ограждений занесем в табл. 1.
Табл. 1. Составляющие теплопритока от ограждений
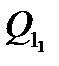 , Вт , Вт
|  , Вт , Вт
|  , Вт , Вт
|  , Вт , Вт
|  , Вт , Вт
|  , Вт , Вт
| 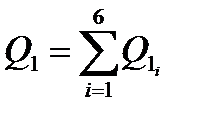 ,Вт ,Вт
|
| 774,76 | 336,05 | 4551,12 | 3461,04 | 10636,97 |
3) Абсо́рбция (лат. absorptio от absorbere — поглощать) — поглощение сорбата всем объёмом сорбента. Является частным случаем сорбции.
В технике и химической технологии чаще всего встречается абсорбция (поглощение, растворение) газов жидкостями. Но известны и процессы абсорбции газов и жидкостей кристаллическими и аморфными телами (например, абсорбция водорода металлами, абсорбция низкомолекулярных жидкостей и газов цеолитами, абсорбция нефтепродуктов резинотехническими изделиями и т.п.).Часто в процессе абсорбции происходит не только увеличение массы абсорбирующего материала, но и существенное увеличение его объема (набухание), а также изменение его физических характеристик – вплоть до агрегатного состояния.На практике абсорбция чаще всего применяется для разделения смесей, состоящих из веществ, имеющих различную способность к поглощению подходящими абсорбентами. При этом целевыми продуктами могут быть как абсорбировавшиеся, так и не абсорбировавшиеся компоненты смесей. Явления абсорбции широко распространены не только в промышленности, но и в природе (пример - набухание семян), а также в быту. При этом они могут приносить как пользу, так и вред (например, физическая абсорбция атмосферной влаги приводит к набуханию и последующему расслоению деревянных изделий, химическая абсорбция кислорода резиной - к потере ею эластичности и растрескиванию). Различают физическую абсорбцию и хемосорбцию.
При физической абсорбции процесс поглощения не сопровождается химической реакцией.
При хемосорбции абсорбируемый компонент вступает в химическую реакцию с веществом абсорбента
Билет № 13
1). Уравнение состояния. Пример расчета
УРАВНЕНИЯ СОСТОЯНИЯ, ур-ния, выражающие связь между параметрами состояния физически однородной системы при термодинамич. равновесии. Термическое уравнение состояния связывает давление р с объемом V и т-рой T, а для многокомпонентных систем - также с составом (молярными долями компонентов). Калорическое уравнение состояния выражает внутр. энергию системы как ф-цию V, T и состава. Обычно под уравнением состояния, если специально не оговаривается, подразумевают термич. уравнение состояния. Из него можно непосредственно получить коэф. термич. расширения, коэф. изотермич. сжатия, термич. коэф. давления (упругости). Уравнение состояния является необходимым дополнением к термодинамич. законам. Пользуясь уравнениями состояния, можно раскрыть зависимость термодинамич. ф-ций от V и р, проинтегрировать дифференц. термодинамич. соотношения, рассчитать летучести (фугитивносги) компонентов системы, через к-рые обычно записывают условия фазового равновесия.

Пример расчета свойств газа с использованием уравнения состояния
Рассчитать коэффициент сверхсжимаемости z, плотность и объем нефтяного газа при абсолютном давлении Р = 3 МПа и температуре Т = 308 °К. Объем газа, добываемого скаждым кубическим метром нефти при нормальных условиях составляет Vо = 60 м3/м3. Компонентный молярный состав газа приведен в таблице 3. Относительная плотность газа по воздуху ρг = 1,119, а плотность при нормальных условиях pro=1,447 кг/м3
Решение
Определяем коэффициент сверхсжимаемости углеводородной части газа zy, для чего исключаем из состава газа азот уа = 0,069 и пересчитываем концентрацию углеводородных компонентов уi‘, (см. таблицу), используя выражение:

Приведенные параметры по данным компонентного состава рассчитываем по формулам (14). Для этого рассчитываем в таблице псевдокритические параметры углеводородной части газа:
Рп кр = 4,5 Мпа; Тп кр = 294,7 °К,
откуда приведенные параметры равны:

Относительную плотность углеводородной составляющей газа определяем по формуле (16):
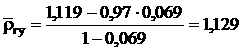
Приведенные параметры углеводородной части газа можно рассчитать и по формулам Ляпкова:


Коэффициент сверхсжимаемости углеводородной части газа рассчитывается по аппроксимационной формуле (19):
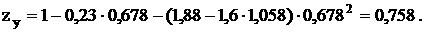
Коэфициент сверхсжимаемости нефтяного газа по формуле (17) равен:

Плотность газа при Р = 3 МПа и Т = 308 °К, учитывая, что его плотность при нормальных условиях 1,447 кг/м3, составляет по формуле (22):
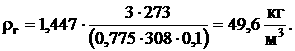
Объем газа, добываемого с 1 м3
нефти при Р = 3 МПа и Т = 308 °К, получится равным по формуле (23):

2)Расчет теплопритока от груза и тары.
Дано:Условная емкость камеры Еусл.=200 т;
Продукт -свининина охлажденная;
Тары-контейнеры специальные в 2 яруса;
Температура поступления tпост=+4С;
Температура хранения tхрен=-3С;
Система охлаждения -насосно-циркуляционная
Хладагент-R717
Решение:
Теплопритоки от грузов при холодильной обработке
Теплоприток от технологической нагрузки:
 где
где 
 -теплопритоки от груза и тары
-теплопритоки от груза и тары
Суточное поступление продукта:

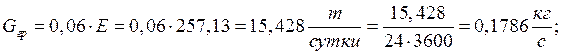
Теплоприток от тары камеры:


Теплоприток от технологической наргрузки:

3).Адсорбция.Основные понятия.
Адсорбция (лат. ad — на, при, в; sorbeo — поглощаю) — увеличение концентрации растворенного вещества у поверхности раздела двух фаз (твердая фаза — жидкость, конденсированная фаза — газ)вследствие
нескомпенсированности сил межмолекулярного взаимодействия на разделе фаз[1].Адсорбция является частным случаем сорбции, процесс, обратный адсорбции — десорбция[2].
Основные понятия. Поглощаемое вещество, ещё находящееся в объёме фазы, называют адсорбтив,поглощённое — адсорбат. В более узком смысле под адсорбцией часто понимают поглощение примеси из газа или жидкости твёрдым веществом (в случае газа и жидкости) или жидкостью (в
случае газа) — адсорбентом. При этом, как и в общем случае адсорбции, происходит концентрирование примеси на границе раздела адсорбент-жидкость либо адсорбент-газ. Процесс,обратный адсорбции, то есть перенос вещества с поверхности раздела фаз в объём фазы, называется десорбция. Если скорости адсорбции и десорбции равны, то говорят об установлении адсорбционного равновесия. В состоянии равновесия количество адсорбированных молекул
остается постоянным сколь угодно долго, если неизменны внешние условия (давление, температура и состав системы)
Адсорбция и хемосорбция.На поверхности раздела двух фаз помимо адсорбции, обусловленной в основном физическими взаимодействиями (главным образом это Ван-дер-Ваальсовы силы), может идти химическая реакция. Этот процесс называется хемосорбцией. Одним из основных параметров по которым различаются эти явления является тепловой эффект: так, тепловой эффект физической адсорбции обычно близок к теплоте сжижения адсорбата, тепловой эффект хемосорбции значительно выше. Кроме того в отличие от адсорбции хемосорбция обычно является необратимой и локализованной.
Причиной адсорбции являются неспецифические (то есть не зависящие от природы вещества) Ван-дер-Ваальсовы силы. Адсорбция, осложнённая химическим взаимодействием между адсорбентом и адсорбатом, является особым случаем. Явления такого рода называют хемосорбцией и химической
адсорбцией. «Обычную» адсорбцию в случае, когда требуется подчеркнуть природу сил взаимодействия, называют физической адсорбцией.Физическая адсорбция является обратимым процессом, условие равновесия определяется равными скоростями адсорбции молекул адсорбтива
Значение адсорбции
Адсорбция — всеобщее и повсеместное явление, имеющее место всегда и везде, где есть поверхность раздела между фазами. Наибольшее практическое значение имеет адсорбция поверхностно-активных веществ и адсорбция примесей из газа либо жидкости специальными высокоэффективными адсорбентами. В качестве адсорбентов могут выступать разнообразные
материалы с высокой удельной поверхностью: пористый углерод (наиболее распространённая форма — активированный уголь), силикагели, цеолиты а также некоторые другие группы природных
минералов и синтетических веществ.
Билет № 14
1). Вопрос №1 «Перспективы применение хладагентов озоноопасных (ODP) и с высоким потенциалом глобального потепления»
Холодильный агент, хладагент, рабочее вещество холодильной машины, которое при кипении или в процессе расширения отнимает теплоту от охлаждаемого объекта и затем после сжатия передаёт её охлаждающей среде (воде, воздуху и т. п.). К хладагентам предъявляется ряд требований: они должны иметь низкую температуру кипения при давлениях выше атмосферного (во избежание подсоса воздуха), умеренные давление и температуру конденсации, низкую температуру затвердевания и высокую критическую температуру, большую теплоту парообразования при малых удельных объёмах паров, малую теплоёмкость и высокую теплопроводность. Кроме того, желательно, чтобы хладагенты были взрывобезопасными, нетоксичными, негорючими, нейтральными к конструкционным материалам, инертными к смазке и т. д. В зависимости от температуры кипения при атмосферном давлении Х. а. подразделяют на 3 группы: высокотемпературные (выше —10 °С), умеренные (ниже —10 °С) и низкотемпературные (ниже —50 °С). Основными холодильными агентами являются аммиак, фреоны (хладоны) и некоторые углеводороды. Аммиак относится к группе умеренных холодильных агентов.
В настоящее время хладагент R22 является одним из основных хладагентов, используемым в холодильных системах. Однако данный хладагент, из-за его влияния на озоновый слой Земли не может быть использован в долгосрочной перспективе в соответствии с государственным регулированием оборота озоноразрушающих веществ и содержащей их продукции, так как потенциал озонобезопасности равен 0.05 (ODP=0,05). На сегодняшний день разработан и всесторонне испытан ряд хлор-несодержащих хладагентовс ODP=0 альтернатив.
|
|
|


