 |
2.1.2 Производим перерасчет. 2.2 Определение объема и парциальных давлений продуктов сгорания. 2.3 Определение энтальпии продуктов сгорания
|
|
|
|
2. 1. 2 Производим перерасчет
2. 1. 2. 1 Рабочая масса углерода, 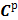 , %
, %
 , (1)
, (1)
2. 1. 2. 2 Рабочая масса водорода, 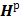 , %
, %
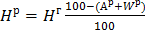 , (2)
, (2)
2. 1. 2. 3 Рабочая масса серы, 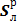 , %
, %
 , (3)
, (3)
2. 1. 2. 4 Рабочая масса азота,  , %
, %
 , (4)
, (4)
2. 1. 2. 5 Рабочая масса кислорода, 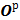 , %
, %
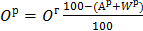 , (5)
, (5)
 %, (6)
%, (6)
2. 2 Определение объема и парциальных давлений продуктов сгорания
2. 2. 1 Теоретическое количество воздуха на 1 кг топлива, 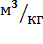
а) сухого, 
 , (7)
, (7)
б) влажного, 
 , (8)
, (8)
d —влагосодержание воздуха, 8—10г/кг;
2. 2. 2 Действительное количество воздуха на 1 кг топлива, 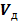 ,
, 
Для полного сгорания 1 кг топлива необходимо израсходовать определенное количество воздуха. Если воздуха взять недостаточное количество, то будет происходить неполное сгорание топлива. Если воздуха взять больше, чем надо для полного сгорания 1 кг топлива, то продукты сгорания будут иметь более низкую температуру, чем при полном сгорании топлива, а реакция сгорания будет протекать медленно, вяло.
Теоретический расход воздуха достаточен для полного сгорания топлива только при условии создания идеальной горючей газовой смеси, состоящей из отдельных молекул, и при условии, когда каждая молекула горючих элементов имеет возможность прореагировать с кислородом воздуха. Поэтому в реальных условиях для обеспечения полного сгорания 1 кг топлива воздуха подается больше, в количестве равном
|
|
|
 , (9)
, (9)
где VД – действительный расход воздуха, м3 / кг;
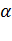 – коэффициент избытка воздуха, который равен отношению действительного расхода воздуха к теоретически необходимому. Его значение зависит от вида топлива, метода его сжигания, конструкции топочного устройства и колеблется в пределах 1, 05 – 1, 6. Чем благоприятнее условия смешения топлива с воздухом, тем меньше величина коэффициента избытка воздуха a. Например, природный газ, состоящий из отдельных молекул, легко смешивается с воздухом и имеет минимальное значение a, равное 1, 03÷ 1, 1. Для жидкого топлива, которое распыляется на мелкие капли, a =1, 1÷ 1, 2. При сжигании кускового твердого топлива a = 1, 3 ÷ 1, 6.
– коэффициент избытка воздуха, который равен отношению действительного расхода воздуха к теоретически необходимому. Его значение зависит от вида топлива, метода его сжигания, конструкции топочного устройства и колеблется в пределах 1, 05 – 1, 6. Чем благоприятнее условия смешения топлива с воздухом, тем меньше величина коэффициента избытка воздуха a. Например, природный газ, состоящий из отдельных молекул, легко смешивается с воздухом и имеет минимальное значение a, равное 1, 03÷ 1, 1. Для жидкого топлива, которое распыляется на мелкие капли, a =1, 1÷ 1, 2. При сжигании кускового твердого топлива a = 1, 3 ÷ 1, 6.
2. 2. 3 Объем, 
Полный объем газообразных продуктов сгорания, покидающих котел, м3/кг:
Vпс = VN2 + VH2O + VRО2 + VR2,
где VN2 — объем азота;
VH2O — объем водяного пара;
VRO2 — объем трехатомных газов;
VR2 — объем двухатомных газов.
Рассмотрим метод определения составляющих уравнения [7].
Объем азота VN2, м3/кг, складывается из поступающего с воздухом,
в котором его по объему содержится 79 %, и азота топлива.
Суммарный объем азота равен:
VN2 = 0, 79α Vсух о + 0, 8Nр;
а) трехатомных газов, 
 , (10)
, (10)
б) двухатомных газов, 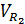
 , (11)
, (11)
в) водяных паров, 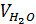
|
|
|
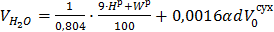 , (12)
, (12)
г) продуктов сгорания (суммарный), 
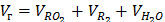 , (13)
, (13)
д) углекислого газа, 
 , (14)
, (14)
2. 2. 4 Парциальное давление трехатомных газов, 
Газовая смесь находится в состоянии равновесия, если концентрации компонентов и её параметры состояния во всём объёме имеют одинаковые значения. При этом температура всех газов, входящих в смесь, одинакова и равна температуре смеси Тсм.
В равновесном состоянии молекулы каждого газа рассеяны равномерно по всему объёму смеси, то есть имеют свою определённую концентрацию и, следовательно, своё давление рi, Па, которое называется парциальным.
а) углекислого газа, 
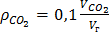 , (15)
, (15)
б) водяных паров, 
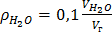 , (16)
, (16)
в) суммарное, 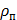
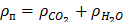 , (17)
, (17)
2. 3 Определение энтальпии продуктов сгорания
После определения объема продуктов сгорания приступают к построению диаграммы I—t, основы для теплового расчета котла.
2. 3. 1 Энтальпия, i, , вычисляется по формуле
Энтальпия — количество теплоты, затраченное на нагревание объема газов от 0 до t оС. Величину энтальпии относят к объему газов, полученных в результате полного сгорания 1 кг топлива. Ее выражают в размерности [кДж/кг].
Энтальпия продуктов сгорания, представляющих собой смесь различных газов, определяется как сумма произведений теплоемкостей отдельных составляющих на их объемы и температуру смеси. Таким образом, энтальпия действительного объема продуктов сгорания одного килограмма топлива, сгорающего с коэффициентом избытка воздуха α > 1, равна, кДж/кг
I = (VRO2CRO2 +VN2CN2 + VH2OCH2O + VR2CR2)t, (17. 1)
где CRO2, CN2, CH2O, CR2 — средние объемные изобарные теплоемкости соответствующих газов, кДж/(м3°С).
|
|
|
Энтальпия продуктов сгорания топлива одного и того же состава зависит от значения коэффициента избытка воздуха α. С его ростом увеличивается объем газов, покидающих котел. Поэтому для топлива одного и того же состава можно построить семейство кривых I = f(t), каждая из которых будет соответствовать различным значениям α.
Как видно из рис. 1, с ростом величины α при одной и той же температуре t энтальпия газа возрастает. Это объясняется тем, что для нагревания до той же температуры возросшего объема газов требуется большее количество тепла, а значит, — при этом продукты сгорания обладают более высокой внутренней энергией, то есть энтальпией.

Рисунок 1. Влияние коэффициента избытка воздуха на форму кривой I—t
|
|
|


