 |
18. Свойства α-Аминокислот. Кислотно-основные свойства. Понятие об изоэлектрической точке (рI).
|
|
|
|
17. α -Аминокислоты. Строение, классификация α -Аминокислот по природе радикала: алифатические, ароматические, гетероциклические. Заменимые и незаменимые α -Аминокислоты. Привести примеры.
α -Аминокислоты - гетерофункциональные соединения, молекулы которых содержат одновременно аминогруппу и карбоксильную группу у одного и того же атома углерода.
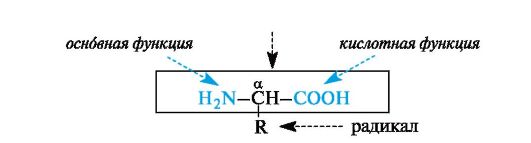
Многие α -аминокислоты синтезируются в организме. Некоторые аминокислоты, необходимые для синтеза белков, в организме не образуются и должны поступать извне. Такие аминокислоты называют незаменимыми
К незаменимым α -аминокислотам относятся:
валин изолейцин метионин триптофан
лейцин лизин треонин фенилаланин
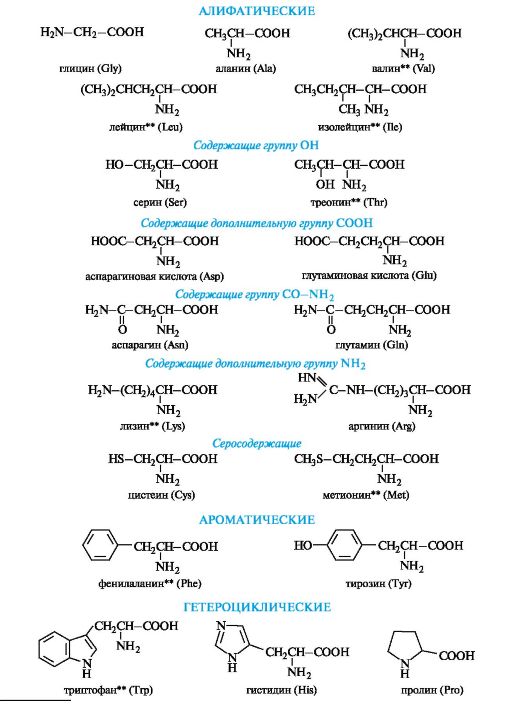
Алифатические α -аминокислоты. Это наиболее многочисленная группа. Внутри нее аминокислоты подразделяют с привлечением дополнительных классификационных признаков.
В зависимости от числа карбоксильных групп и аминогрупп в молекуле выделяют:
• нейтральные аминокислоты - по одной группе NH2 и СООН;
• основные аминокислоты - две группы NH2 и одна группа
СООН;
• кислые аминокислоты - одна группа NH2 и две группы СООН.
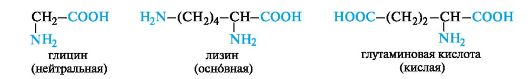
Можно отметить, что в группе алифатических нейтральных аминокислот число атомов углерода в цепи не бывает больше шести. При этом не существует аминокислоты с четырьмя атомами углерода в цепи, а аминокисоты с пятью и шестью атомами углерода имеют только разветвленное строение (валин, лейцин, изолейцин).
В алифатическом радикале могут содержаться «дополнительные» функциональные группы:
• гидроксильная - серин, треонин;
• карбоксильная - аспарагиновая и глутаминовая кислоты;
|
|
|
• тиольная - цистеин;
• амидная - аспарагин, глутамин.
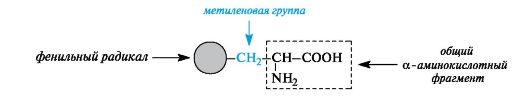
Ароматические α -аминокислоты. К этой группе относятся фенилаланин и тирозин, построенные таким образом, что бензольные кольца в них отделены от общего α -аминокислотного фрагмента метиленовой группой -СН2-.
Гетероциклические α -аминокислоты. Относящиеся к этой группе гистидин и триптофан содержат гетероциклы - имидазол и индол соответственно. Строение и свойства этих гетероциклов рассмотрены ниже (см. 13. 3. 1; 13. 3. 2). Общий принцип построения гетероциклических аминокислот такой же, как и ароматических.
Гетероциклические и ароматические α -аминокислоты можно рассматривать как β -замещенные производные аланина.
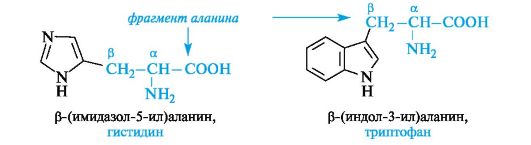
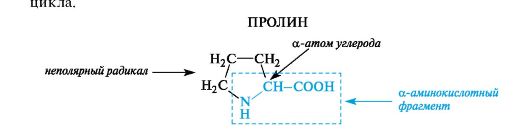
К героциклическим относится также аминокислота пролин, в которой вторичная аминогруппа включена в состав пирролидинового
18. Свойства α -Аминокислот. Кислотно-основные свойства. Понятие об изоэлектрической точке (рI).
Пояснить на конкретном примере.
Амфотерность аминокислот обусловлена кислотными (СООН) и основными (NH2) функциональными группами в их молекулах. Аминокислоты образуют соли как со щелочами, так и с кислотами.

В кристаллическом состоянии α -аминокислоты существуют как диполярные ионы H3N+ - CHR-COO- (обычно используемая запись
строения аминокислоты в неионизированной форме служит лишь для удобства).
В водном растворе аминокислоты существуют в виде равновесной смеси диполярного иона, катионной и анионной форм.

Положение равновесия зависит от рН среды. У всех аминокислот преобладают катионные формы в сильнокислых (рН 1-2) и анион- ные - в сильнощелочных (рН > 11) средах.
Ионное строение обусловливает ряд специфических свойств аминокислот: высокую температуру плавления (выше 200? С), растворимость в воде и нерастворимость в неполярных органических растворителях. Способность большинства аминокислот хорошо растворяться в воде является важным фактором обеспечения их биологического функционирования, с нею связаны всасывание аминокислот, их транспорт в организме и т. п.
|
|
|
Положение равновесия, т. е. соотношение различных форм аминокислоты, в водном растворе при определенных значениях рН существенно зависит от строения радикала, главным образом от присутствия в нем ионогенных групп, играющих роль дополнительных кислотных и основных центров.
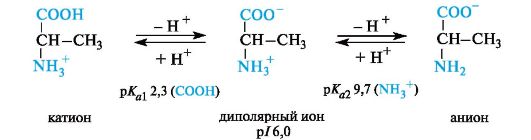
Значение рН, при котором концентрация диполярных ионов максимальна, а минимальные концентрации катионных и анионных форм аминокислоты равны, называется изоэлектрической точкой (p/).
Нейтральные α -аминокислоты. Эти аминокислоты имеют значения рI несколько ниже 7 (5, 5-6, 3) вследствие большей способности к ионизации карбоксильной группы под влиянием -/-эффекта группы NH2. Например, у аланина изоэлектрическая точка находится при рН 6, 0.
Кислые α -аминокислоты. Эти аминокислоты имеют в радикале дополнительную карбоксильную группу и в сильнокислой среде находятся в полностью протонированной форме. Кислые аминокислоты являются трехосновными (по Брёндстеду) с тремя значениями рКа, как это видно на примере аспарагиновой кислоты (р/ 3, 0).
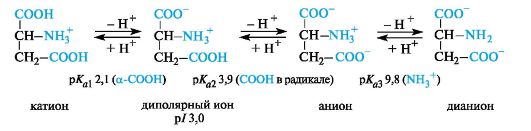
У кислых аминокислот (аспарагиновой и глутаминовой) изоэлектрическая точка находится при рН много ниже 7 (см. табл. 12. 1). В организме при физиологических значениях рН (например, рН крови 7, 3-7, 5) эти кислоты находятся в анионной форме, так как у них ионизированы обе карбоксильные группы.
Основные α -аминокислоты. В случае основных аминокислот изоэлектрические точки находятся в области рН выше 7. В сильно- кислой среде эти соединения также представляют собой трехосновные кислоты, этапы ионизации которых показаны на примере лизина (р/ 9, 8).
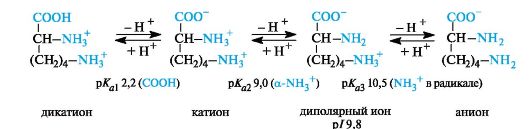
В организме основные аминокислоты находятся в виде катионов, т. е. у них протонированы обе аминогруппы.
В целом ни одна α -аминокислота in vivo не находится в своей изоэлектрической точке и не попадает в состояние, отвечающее наименьшей растворимости в воде. Все аминокислоты в организме находятся в ионной форме.
|
|
|


