 |
Окислительно-восстановительные реакции
|
|
|
|
Все химические реакции можно разбить на две группы. В реакциях первой группы степень окисления всех элементов, входящих в состав реагирующих веществ, остается неизменной, а в реакциях второй группы степень окисления одного или нескольких элементов изменяется.
В качестве примера реакций первой группы можно привести реакцию нейтрализации:
НСl + NaOH = NaCl + Н2О.
Примером реакции второй группы может служить взаимодействие металла с кислотой:
Zn + 2HCl = ZnCl2 + H2.
Если при реакции нейтрализации ни один элемент не изменяет своей степени окисления, то во втором примере степень окисления цинка изменяется от 0 до +2, а водорода – от +1 до 0.
Реакции, в результате которых изменяются степени окисления элементов, называются окислительно-восстановительными.
Окислительно-восстановительные реакции имеют очень большое значение в биологических системах. Фотосинтез, дыхание, пищеварение – все это цепи окислительно-восстановительных реакций. В технике значение окислительно-восстановительных реакций также очень велико. Так, вся металлургическая промышленность основана на окислительно-восстановительных процессах, в ходе которых металлы выделяются из природных соединений.
Простым примером окислительно-восстановительной реакции может служить реакция образования ионного соединения из простых веществ, например, взаимодействие натрия с хлором:
2Na + С12 = 2NaCl.
Эта реакция, как всякая гетерогенная реакция, протекает в несколько стадий. В ходе одной из них атомы натрия превращаются в положительно заряженные ионы; степень окисления натрия изменяется от 0 до +1:
Na – e = Na+.
Такой процесс – отдача электронов, сопровождающаяся повышением степени окисления элемента, – называется окислением.
|
|
|
Электроны, отдаваемые натрием, принимаются атомами хлора, которые превращаются при этом в отрицательно заряженные ионы; степень окисления хлора изменяется от 0 до –1:
С12 + 2е = 2Сl–.
Присоединение электронов, сопровождающееся понижением степени окисления элемента, называется восстановлением.
Таким образом, в рассматриваемой реакции натрий окисляется, а хлор восстанавливается.
Вещество, в состав которого входит окисляющийся элемент, называется восстановителем, а вещество, содержащее восстанавливающийся элемент, – окислителем. Следовательно, в данном примере натрий – восстановитель, а хлор – окислитель.
Из уравнений процессов восстановления и окисления видно, что одна молекула хлора, восстанавливаясь, присоединяет два электрона, а окисление одного атома натрия сопровождается отдачей одного электрона. Общее число электронов в системе не изменяется: число электронов, отдаваемых атомами восстановителя (натрия), равно числу электронов, присоединяемых молекулами окислителя (хлора). Поэтому одна молекула хлора может окислить два атома натрия.
1.3.1 Составление уравнений окислительно-восстановительных реакции
Окислительно-восстановительные реакции обычно уравнивают одним из двух ниже рассмотренных методов: методом электронного баланса и методом полуреакций.
1.3.1.1. Метод электронного баланса.
Метод электронного баланса уравнивания окислительно-восстановительных реакций заключается в выполнении следующего правила: число электронов, отданных всеми частицами восстановителей, всегда равно числу электронов, присоединенных всеми частицами окислителей в данной реакции.
Уравнивание окислительно-восстановительных реакций этим методом требует знания формул исходных веществ и продуктов реакции, умения рассчитывать степени окисления элементов в молекулах и ионах и строгого соблюдения очередности действий. Проиллюстрируем это на конкретном примере окисления сульфита калия дихроматом калия в кислой среде.
|
|
|
1 Записываем уравнение реакции:
К2Сr2O7 + K2SO3 + H2SO4 ® Cr2(SO4)3 + K2SO4 + H2O.
2 Определяем СО всех элементов:
+1+6 –2 +1 +4 –2 +1 +6 –2 +3 +6–2 +1 +6 –2 +1–2
К2Сr2O7 + K2SO3 + H2SO4 ® Cr2(SO4)3 + K2SO4 + H2O
3 Находим элементы, изменившие СО в процессе реакции:
+6 +4 +3 +6
К2 Сr 2O7 + K2 S O3 + H2SO4 ® Cr 2(SO4)3 + K2 S O4 + H2O
и условно записываем процессы окисления и восстановления элементов в их соединениях:
окислитель Сr+6 + 3e- ® Сr+3 – процесс восстановления;
восстановитель S+4 – 2 e- ® S+6 – процесс окисления.
4 Затем составляется электронный баланс.
Для этого подсчитывают число электронов, которое нужно присоединить всеми атомами окислителя, входящими в состав молекулы-окислителя, и прибавляют их число в левой части схемы процесса восстановления.
В данном примере хром из степени окисления +6 переходит в степень окисления +3, поэтому нужно прибавить три электрона (3е). Однако в молекуле окислителя К2Сr2О7 содержится два атома хрома, тогда в соответствующей схеме указываются эти два атома хрома слева и справа и увеличивается в 2 раза число присоединяемых электронов. Аналогично поступают и с восстановителем, только теперь в левой части схемы отнимают электроны. В результате имеем
2Сr+6 + 6e ® 2Сr+3;
S+4 – 2 e ® S+6
Электронный баланс достигается тогда, когда числа электронов в каждой из этих схем, взятых целое число раз, равны друг другу. Для этого находим наименьшее общее кратное для числа отданных и принятых электронов – это 6. Видно, что молекула окислителя присоединяет в 3 раза больше электронов, чем молекула восстановителя их отдает. Поэтому, чтобы соблюдался электронный баланс второй процесс – окисление восстановителя – должен осуществляться в три раза чаще, чем первый. Это отражается коэффициентами справа от записанных схем:
 2Сr+6 + 6e- ® 2Сr+3 2Сr+6 + 6e- ® 2Сr+3
|  6 6
|  
| ||
| S+4 – 2 e- ® S+6 |
5 Полученные коэффициенты ставим перед окислителем и восстановителем в левой части уравнения и перед продуктами их восстановления и окисления – в правой части уравнения (коэффициент 1 не пишется):
|
|
|
К2Сr2O7 + 3K2SO3 + H2SO4 ® Cr2(SO4)3 + 3K2SO4 + H2O.
6 Далее сначала уравниваем ионы металла, не изменяющие своей степени окисления, а участвующие лишь в связывании анионов среды. В данном примере такими ионами являются ионы К+, входившие в состав дихромата калия. После перехода хрома в состав молекулы сульфата хрома они остались несвязанными. За счет среды реакции – серной кислоты они объединяются с сульфат-ионами. Поэтому для уравнивания этих ионов калия переписываем их в правую часть уравнения в составе новой молекулы сульфата калия:
К2Сr2O7 + 3K2SO3 + H2SO4 ® Cr2(SO4)3 + 3K2SO4 + K2SO4 + H2O.
7 Определяем коэффициент перед средой. Средой является серная кислота, которая поставляет сульфатные группы SО  для связывания катионов в виде солей. В правой части уравнения видно, что в составе солей находится семь сульфатных групп, причем три из них получены в результате окисления сульфита калия. Значит, на солеобразование потребовались оставшиеся четыре сульфатные группы. Поэтому перед формулой серной кислоты в уравнении реакции ставим коэффициент 4:
для связывания катионов в виде солей. В правой части уравнения видно, что в составе солей находится семь сульфатных групп, причем три из них получены в результате окисления сульфита калия. Значит, на солеобразование потребовались оставшиеся четыре сульфатные группы. Поэтому перед формулой серной кислоты в уравнении реакции ставим коэффициент 4:
К2Сr2O7 + 3K2SO3 + 4H2SO4 ® Cr2(SO4)3 + 4K2SO4 + H2O.
8 Уравниваем число атомов водорода за счет подбора коэффициента в правой части уравнения перед водой (коэффициент равен 4):
К2Сr2O7 + 3K2SO3 + 4H2SO4 ® Cr2(SO4)3 + 4K2SO4 + 4H2O.
9 Проверяется правильность подбора коэффициентов подсчетом числа атомов кислорода слева и справа в уравнении реакции:
7 + 9 +16 = 12 + 16 + 4
32 = 32.
Равенство имеется, значит, в уравнении реакции стрелку ® можно заменить знаком равенства. Уравнение реакции составлено:
К2Сr2O7 + 3K2SO3 + 4H2SO4 = Cr2(SO4)3 + 4K2SO4 + 4H2O.
1.3.1.2. Метод полуреакций.
Метод применяется для уравнивания реакций, протекающих в растворах. При этом отпадает необходимость в определении степеней окисления. Часто при уравнивании этим методом сначала неизвестны и продукты реакции – они выявляются в ходе самого уравнивания. Однако для правильного применения этого метода необходимо уметь записывать ионно-молекулярные реакции. Рассмотрим тот же самый пример.
|
|
|
Запишем исходные вещества реакции окисления сульфита калия дихроматом калия в ионно-молекулярной форме. При этом учитываем, что все сильные электролиты записывают в виде ионов:
2K+ +Cr2O 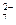 + 2K+ + SO
+ 2K+ + SO  + H+ + HSO
+ H+ + HSO  ®2Cr3+ +3SO
®2Cr3+ +3SO  + 2K+ + SO
+ 2K+ + SO  + H2O.
+ H2O.
Известно, что в кислой среде дихромат-ион, восстанавливаясь, переходит в ион хрома Сr3+, а сульфит-ион, окисляясь, превращается в сульфат-ион. Запишем эти процессы в виде двух полуреакций:
Cr2O 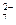 ® Cr3+; SO
® Cr3+; SO  ® SO
® SO  .
.
Цель дальнейших действий заключается в том, чтобы в данных полуреакциях вместо стрелок, отражающих возможное направление реакции, поставить знаки равенства. Это можно будет сделать тогда, когда в левой и правой частях каждой полуреакции будут совпадать виды элементов, число их атомов и суммарные заряды всех частиц. Чтобы добиться этого, используют дополнительные ионы и молекулы среды. Обычно ими являются ионы водорода (в кислой среде), гидроксид-ионы (в щелочной) и молекулы воды. В первой полуреакции слева содержится два атома хрома, а в правой части – один. Уравниваем их число, ставя коэффициент 2 в правой части:
Cr2O 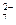 ® 2Cr3+; SO
® 2Cr3+; SO  ® SO
® SO  .
.
Теперь в каждой полуреакции уравнены числа атомов хрома и серы, однако не равны числа атомов кислорода. Дополнительные атомы кислорода в полуреакциях вводятся добавлением молекул воды в правой или левой частях уравнений полуреакций. В первой полуреакции справа не хватает семи атомов кислорода, поэтому добавляем туда семь молекул воды. Во второй полуреакции теперь уже слева не хватает одного атома кислорода, поэтому добавляем слева одну молекулу воды:
Cr2O  ® 2Cr3+ + 7H2O; SO
® 2Cr3+ + 7H2O; SO  + H2O ® SO
+ H2O ® SO  .
.
Однако теперь появились атомы водорода в обеих полуреакциях. Их число уравнивают соответствующим добавлением в другой части уравнения эквивалентного числа ионов водорода:
Cr2O 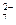 + 14H+ ® 2Cr3+ + 7H2O; SO
+ 14H+ ® 2Cr3+ + 7H2O; SO  + H2O ® SO
+ H2O ® SO  + 2H+.
+ 2H+.
Теперь уравнены все элементы, входящие в уравнения полуреакций. Осталось уравнять заряды частиц. В правой части первой полуреакции сумма всех зарядов частиц равна +6, в то время как слева заряд равен +12. Равенства зарядов добиваемся добавлением в левую часть уравнения шести отрицательных зарядов в виде электронов (6е). Аналогично в уравнении второй полуреакции необходимо вычесть слева 2е.Теперь можем поставить и знаки равенства в уравнениях обеих полуреакций:
Cr2O 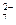 + 14H+ + 6e ® 2Cr3+ + 7H2O (восстановление);
+ 14H+ + 6e ® 2Cr3+ + 7H2O (восстановление);
SO  + H2O – 2е ® SO
+ H2O – 2е ® SO  + 2H+ (окисление).
+ 2H+ (окисление).
В рассматриваемом примере отношение числа электронов, принимаемых в процессе восстановления, к числу электронов, высвобождающихся при окислении, равно 6: 2. Для получения суммарного уравнения реакции надо, суммируя уравнения процессов восстановления и окисления, учесть это соотношение – умножить уравнение восстановления на 2, а уравнение окисления – на 6. Или, сокращая данные множители на 2, уравнение окисления умножаем на 1, а уравнение восстановления – на 3. При этом в записи обычно справа от вертикальной черты проставляются необходимые множители:
|
|
|
 Cr2O
Cr2O 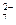 + 14H+ + 6e = 2Cr3+ + 7H2O 1
+ 14H+ + 6e = 2Cr3+ + 7H2O 1
SO  + H2O – 2е = SO
+ H2O – 2е = SO  + 2H+ 3
+ 2H+ 3
Умножая на полученные коэффициенты все члены уравнений полуреакций и суммируя между собой только правые и только левые их части, получаем окончательное уравнение реакции в ионно-молекулярной форме:
Cr2O 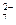 + 14H+ + 6e = 2Cr3+ + 7H2O
+ 14H+ + 6e = 2Cr3+ + 7H2O
 3SO
3SO  + 3H2O – 6е = 3SO
+ 3H2O – 6е = 3SO  + 6H+
+ 6H+
Cr2O 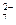 + 14H+ + 6e + 3SO
+ 14H+ + 6e + 3SO  + 3H2O – 6е = 2Cr3+ + 7H2O + 3SO
+ 3H2O – 6е = 2Cr3+ + 7H2O + 3SO  + 6H+.
+ 6H+.
Сокращая подобные члены, получаем
Cr2O 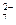 + 8H+ + 3SO
+ 8H+ + 3SO  = 2Cr3+ + 4H2O + 3SO
= 2Cr3+ + 4H2O + 3SO  .
.
Данное уравнение реакции может быть представлено и в молекулярной форме с добавлением необходимых ионов в левую и правую части уравнения:
Cr2O 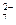 + 8H+ + 3SO
+ 8H+ + 3SO  = 2Cr3+ + 4H2O + 3SO
= 2Cr3+ + 4H2O + 3SO 
 +2К+ + 4SO
+2К+ + 4SO  + 6К+ = +2К+ + 4SO
+ 6К+ = +2К+ + 4SO  + 6К+
+ 6К+
К2Сr2O7 + 3K2SO3 + H2SO4 ® Cr2(SO4)3 + 3K2SO4 + K2SO4 + 4H2O.
|
|
|


