 |
Полный набор квантовых чисел электронов в атоме, их физический смысл
|
|
|
|
Состояние электрона в атоме определяется набором четырех квантовых чисел, каждое из которых может принимать определенные значения:
Главное квантовое число: n = 1,2,3,…
Орбитальное квантовое число: l = 0,1,2,…,(n-1).
Магнитное квантовое число: m = 0,±1,±2,…,±l.
Спиновое квантовое число: ms = ±1/2
Физический смысл полного набора квантовых чисел электронов в атоме – порядковый номер электронного уровня, определение состояния электрона в атоме, описание электронных оболочек атомов. Каждый электрон в атоме имеет свой собственный «адрес», записанный набором четырех квантовых чисел.
Спектр излучения атома водорода. Правила отбора квантовых чисел. Серии излучения атома водорода
Атом водорода (Z = 1) имеет наиболее простой линейчатый спектр излучения. Частоты спектральных линий для атома водорода и водородоподобных атомов определяются по формуле: v = Rv(1/n2 – 1/n'2), где Rv = Z2me4/8ε02h3 = 3,29 · 1015 с-1 – постоянная Ридберга.
Также эта формула может быть записана через длину волны λ: 1/λ = Rλ(1/n2 – 1/n'2), где Rλ = 1,097 · 107 м-1.
Правила отбора – правила, которые на основе законов сохранения квантовых чисел устанавливают допустимые процессы с участием микросистем (молекул, атомов, ядер, элементарных частиц). Любая микросистема характеризуется определённым набором квантовых чисел. В изолированном состоянии эти квантовые числа у микросистемы остаются неизменными, поскольку являются проявлением соответствующих законов сохранения. Так электрический заряд или полный угловой момент  (момент количества движения) изолированной системы не изменяются, так как существуют законы сохранения электрического заряда и углового момента.
(момент количества движения) изолированной системы не изменяются, так как существуют законы сохранения электрического заряда и углового момента.
|
|
|
В нагретом до высокой температуры водороде можно наблюдать характерный линейчатый спектр. Все спектральные линии группируются в серии в зависимости от того, на какой энергетический уровень переходят электроны.
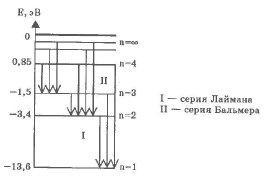
Переходы в первые возбужденные состояния на второй энергетический уровень с верхних уровней образуют серию Бальмера (n = 2), при переходе на первый энергетический уровень с n = 1 образуют серию Лаймана.
Символика обозначений квантовых состояний. Понятие о вырождении. Принцип Паули. Периодическая система Менделеева
Для обозначения квантовых состояний с заданным значением орбитального квантового числа l используют следующие спектроскопические символы:
l 0 1 2 3
Обозначение s p q f
подоболочки
Для обозначения квантовых состояний с заданным значением главного квантового числа n используют следующие спектроскопические символы:
n 1 2 3 4
Обозначение K L M N
оболочки
Энергетический уровень квантовой системы называется вырожденным, если содержит более одного состояния. Говоря математически, соответствующее значение энергии является кратным собственным значением оператора гамильтониана.
Количество независимых таких состояний (т.е. кратность собственного значения) называется кратностью вырождения.
Для многоэлектронных атомов выполняется принцип запрета Паули: в одном и том же атоме не может быть двух электронов, обладающих одинаковым набором четырех квантовых чисел.
Периодическая система химических элементов (таблица Менделеева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от числа протонов в атомном ядре. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году.
В современном варианте системы предполагается сведение элементов в двухмерную таблицу, в которой каждый столбец (число столбцов составляет 8) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
|
|
|
|
|
|


