 |
Энтальпия. Математическое выражение, размерность и физическая сущность.
|
|
|
|
Энтальпия — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
ИЛИ:
Энтальпия — это однозначная функция H состояния термодинамической системы при независимых параметрах энтропии S и давлении P, которая связана с внутренней энергией U соотношением:
Уравение: H = U + PV. Размерность: кДж или кДж/моль
Смысл: Таким образом, энтальпия в данном состоянии представляет собой сумму внутренней энергии тела и работы, которую необходимо затратить, чтобы тело объёмом V ввести в окружающую среду, имеющую давление р и находящуюся с телом в равновесном состоянии. Энтальпия системы H — аналогично внутренней энергии и другим термодинамическим потенциалам — имеет вполне определенное значение для каждого состояния, то есть является функцией состояния.
Формула для определения изменения энтальпии идеального газа?
Для энтальпии идеального газа, подчиняющегося уравнению Pv=RT, будет выполняться равенство

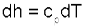 12. Изменения энтальпии в изобарном и адиабатном процессах?
1. Изобарный процесс
Изобарный процесс, протекает при постоянном давлении. Уравнение изобарного процесса Р=const.
В соответствии с уравнением политропы Pvn=const, политропа превращается в изобару Р=const при показателе политропы n=0.
Теплоемкость изобары cР при n=0 соответствует выражению c=cVk=cP.
Доля теплоты, идущая на увеличение внутренней энергии в изобарном процессе, соответствует величине α=1/к. Кроме уравнения Р=const, для изобарного процесса можно записать уравнение
12. Изменения энтальпии в изобарном и адиабатном процессах?
1. Изобарный процесс
Изобарный процесс, протекает при постоянном давлении. Уравнение изобарного процесса Р=const.
В соответствии с уравнением политропы Pvn=const, политропа превращается в изобару Р=const при показателе политропы n=0.
Теплоемкость изобары cР при n=0 соответствует выражению c=cVk=cP.
Доля теплоты, идущая на увеличение внутренней энергии в изобарном процессе, соответствует величине α=1/к. Кроме уравнения Р=const, для изобарного процесса можно записать уравнение 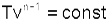 , которое при n=0 превращается в уравнение T/v=const. Таким образом, основные величины, характеризующие изобарный процесс, будут представлены выражениями: , которое при n=0 превращается в уравнение T/v=const. Таким образом, основные величины, характеризующие изобарный процесс, будут представлены выражениями:
Теплота изобарного процесса соответствует выражению:
а работа изменения объема - выражению:
Изменение внутенней энергии, энтальпии и энтропии в изобарном процессе соответствует выражениям:
2. Адиабатный процесс Адиабатный процесс - это процесс без теплообмена с окружающей средой, т.е. для него δq = 0 или q = 0. Уравнение адиабатного процесса соответствует выражению s=const, т.к. δq=Tds=0 при ds=0. Поэтому адиабатный процесс имеет еще одно название - изоэнтропный процесс. Теплоемкость адиабаты равна нулю сs=0, т.к. температура в этом процессе изменяется, а δq=cdT=0. Показатель политропы при сS=0 будет соответствовать выражению n=cP/cV=к, т.е. показатель политропы в адиабатном процессе равен коэффициенту Пуассона. Доля теплоты, идущая на увеличение внутренней энергии в адиабатном процессе равна бесконечности α=∞. Таким образом, основные величины, характеризующие адиабатный процесс будут представлены выражениями:
Теплота адиабатного процесса равна нулю, следовательно, для идеального газа в адиабатном процессе работа равна изменению внутренней энергии, взятой с обратным знаком:
Изменение энтальпии в адиабатном процессе ведется традиционно h2-h1=cP(T2-T1), а изменения энтропии в этом процессе равно нулю s2-s1=0.
|
Адиабатный процесс в PV и TS диаграмме.
Адиабатный – без подвода или отвода теплоты q = 0, q = 0, обратимый адиабатный процесс, кроме того, протекает при постоянной энтропии, т. е. являетсяизоэнтропным s = const, ds = 0;

Изобразить в pv-диаграмме через одну общую точку изотерму и адиабату.

Примеры адиабатных процессов





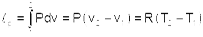

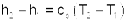


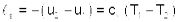
 уравнение адиабаты T=const изотермическое уравнение
уравнение адиабаты T=const изотермическое уравнение