 |
Растворы. Идеальные и неидеальные растворы, отклонения от идеальности.
|
|
|
|
Растворы бывают твердыми жидкими и газообразными.
Истинный раствор – это гомогенная, термодинамически устойчивая система переменного состава, состоящая из двух и более компонентов, между которыми есть сильные взаимодействия. (Кто не выучит тому кол).
Раствор это однофазная система, в которой нет поверхности раздела. Его свойства непрерывно меняются с составом, при образовании раствора происходило уменьшение изобарно-изотермического потенциала и увеличение энтропии, поэтому такая система в неизменных условиях устойчива.
Частицы растворителя и растворенного вещества взаимодействуют между собой. Взаимодействия эти есть всегда. Хотя характер может быть различен. Растворитель может сольватировать и это приведет к отрицательным отклонениям. Здесь взаимодействие между растворителем и растворенным веществом энергетически предпочтительнее, нежели взаимодействия индивидуальных веществ.
Взаимодействия могут быть и такого рода, что растворенное вещество и растворитель меняя способ упаковки молекул в растворе, будут стремиться уйти друг от друга на расстоянии и это приведет к положительным отклонениям. Такое происходит, когда взаимодействия между индивидуальными веществами предпочтительнее, чем веществом и растворителем.
Раулем для идеальных растворов был выведен закон.
Рi = хРoi (13.1)
Давление пара растворителя над растворам Рi прямо пропорционально мольной доли растворителя. Рoi - давление растворителя над чистым растворителем.
Для реальных растворов давление пара растворителя над раствором либо больше (положительные отклонения), либо меньше (отрицательные отклонения).
Величина fi=ai=Pi/P0i –называется активностью или фугитивностью i-го компонента в растворе. В этом отношении суммарно учтены все отклонения от идеальности и, используя его вместо концентрации, мы можем пользоваться всеми уравнениями термодинамики для реальных растворов. Сi = γ iai γ I – коэффициент активности.
|
|
|
Образование любого реального раствора сопровождается тепловыми эффектами. Если положим, мы растворяем, к примеру, NaCl то это будет теплота разрушения кристаллической решетки (эндотермический процесс) и теплота сольватации (экзотермический процесс). Суммарный тепловой эффект будет равен нулю но, понятно что с ростом Т растворимость будет увеличиваться, а сольваты разрушаться.
При смешении исходных веществ сумма объемов исходных веществ не будет равна объему полученного раствора, Vв-во + Vр-тель ≠ Vраствор.
Для отрицательных отклонений:
Тепловой эффект отрицателен ∆Н<0.
При более сильном взаимодействии веществ изменение объема отрицательно Vв-во + Vр-тель < Vраствор. ∆V<0 это эквивалентно работе над системой.
При отрицательных отклонениях γ <1 a=Pi/P0i<1.
Для положительных отклонений:
Тепловой эффект системы положителен ∆Н>0. Такое произойдет, если мы будем смешивать воду и нафталин. Нафталин очень мало растворим в воде, для растворение потребуется затратить энергию извне.
∆V>0, γ >1, a=Pi/P0i>1.
Идеальный раствор – тот, который подчиняется закону Рауля, для которого ∆Н=0, ∆V=0, γ =1, a=Pi/P0i=1, Сi = ai.
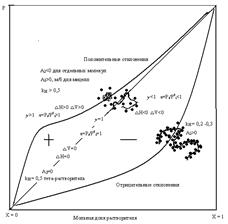
Рис. 2. Зависимость давления пара растворителя над раствором от его мольной доли. Второй компонент твердое вещество.
15. Диаграммы Р = f(состав), Т = f(состав). Азеотропа. Правило рычага.
Если смешиваются два химических соединения то, нельзя сходу сказать, как они поведут себя вместе. Они могут образовать истинный раствор, а могут расслоиться подобно маслу и воде при комнатной температуре. В последнем случае у нас образуется сразу два раствора находящиеся в равновесии друг с другом. Раствор воды в масле и раствор масла в воде.
|
|
|
Нам необходимо охарактеризовать полученные растворы, понять их свойства, чтобы в последствии использовать знания на практике.
Величина, которую всегда стремятся получить это активность. Она позволяет рассчитать химический потенциал смешения. А из последнего можно получить все термодинамические параметры.
a=pi/p0i
∆s i = -RT ln ai, ∆s i = -R ln ai, ∆μ i =∆hi - T∆s i
∆s i, ∆ μ i, ∆hi – парциальные мольные энтропия, энергия Гиббса, энтальпия.
Так как активность зависит от давления пара растворителя над раствором при определенной температуре, то строят зависимости: Pобщ, Pi = f(x,x/), Pобщ = f(x,x/), Tкип = f(x,x/), x/ = f(x),
x – доля вещества в жидкой фазе, x/ - доля вещества в паровой фазе.
Рассмотрим их по порядку.
Pобщ, Pi = f(x,x/).
Кривая АВ на рис 5.1 зависимость общего давления от состава. АD – кривая зависимости парциального давления первого компонента от состава. CB – кривая зависимости второго компонента от состава. Прямые линии соответствуют давлению в идеальном растворе. Доля первого компонента в паровой фазе очевидно равна: X1/ = P1 / P. P1 + P2 = P.


рис 5.1. Pобщ, Pi = f(x,x/). рис. 5.2. Pобщ = f(x,x/).
Pобщ = f(x,x/).
На рис. 5.2 кривая ABC – характеризует при постоянной Т зависимость общего давления пара от состава жидкой фазы. Кривая ADC - зависимость общего давления от состава паровой фазы. В общем случае составы фаз различны. В точке В жидкость имеет состав XM ЖИДК. Раствор находится в равновесии с паровой фазой D. Паровая фаза имеет состав XM ПАРОВ.
Tкип = f(x,x/).
На рис. 5.3 кривая AМ*C - зависимость температуры кипения от состава пара. АМB – кривая зависимости температуры кипения от состава жидкости. Если мы возьмем жидкость состава XM ЖИДК и доведем ее до кипения Тм в точке М, то она будет находиться в равновесии с паровой фазой – точка М* (паровая фаза более богата вторым компонентом). Если мы сконденсируем эту фазу и снова доведем до кипения, у паровой фазы будет новый состав еще более богатый вторым компонентом. На этом основана перегонка.
Правило рычага.
В точке D масса пара так будет относиться к массе жидкости как MD/DM*.
MD/DM* = mпара/mжидк. Если учесть что mпара + mжидк = m общ, то можно определить массовые доли паровой и жидкой фаз.
|
|
|
x/ = f(x).
На рис. 5.4. показана зависимость состава пара от состава жидкости. 

рис. 5.3. Tкип = f(x,x/). рис. 5.4. x/ = f(x).
Азеотропа – точка соответствующая экстремуму (рис. 5.5.) на кривых Pобщ = f(x,x/), Tкип = f(x,x/). В ней составы жидкости и пара одинаковы. Если система имеет азеотропу то можно выделить из раствора одно чистое вещество и азеотропную смесь. Максимум на кривой испарения соответствует минимуму кривой кипения и наоборот. 
рис. 5.5. Азеотропы.
|
|
|


