 |
Составление и анализ математического описания
|
|
|
|
Наличие большого числа разнообразных по природе стадий свидетельствует о сложности механизма химических процессов с участием твердой фазы и создает огромные трудности при их изучении. Поэтому рассмотрим составление и анализ математического описания химического процесса в системе Г—Т на примере более простого механизма. Допустим, что взаимодействие газообразного реагента A с малопористым твердым реагентом В, в результате которого образуется твердый продукт S, происходит по схеме необратимой реакции
AГ + BT = ST. (2.1)
Поскольку процессы в системе Г—Т обычно протекают при высоких температурах, то реакционная поверхность образуется почти мгновенно. После образования сплошного слоя твердого продукта S механизм протекания процесса по (2.1) включает три последовательные стадии (рис. 2.1): 1) диффузия реагента А из ядра газового потока к внешней поверхности зерна; 2) диффузия реагента А через слой твердого продукта S к фронту химической реакции; 3) собственно химическая реакция.

Рис. 2.1. Модель фронта химической реакции:
1 – газовая пленка; 2 – слой продукта; 3 – твердый реагент; 4 – фронт химической реакции.
Описанная модель процесса называется моделью фронта химической реакции (ФХР), или моделью с невзаимодействующим ядром. Наличие значительного класса превращений с аналогичным механизмом (обжиг, сжигание, диссоциация) объясняет широкое использование этой модели при изучении кинетики процессов в системе Г (Ж)—Т.
Составим математическое описание стационарного протекания рассматриваемого процесса при исходных условиях: 1) реакция (2.1) описывается кинетическим уравнением первого порядка по реагенту А; 2) температура и общее давление в ходе процесса постоянны; 3) мольные плотности веществ В и S одинаковы и постоянны ρВ = ρS.
|
|
|
Будем исходить из условия стационарности, согласно которому скорости всех последовательных стадий процесса равны между собой и определяют наблюдаемую скорость химического превращения в процессе
 . (2.2)
. (2.2)
Это означает, что в единицу времени

Составим уравнения скорости всех стадий процесса в соответствии со схемой (рис. 2.1). Скорость внешней диффузии реагента А через неподвижную газовую пленку
 (2.3)
(2.3)
где β – коэффициент массопереноса; F R – внешняя поверхность зерна,  – движущая сила.
– движущая сила.
Поскольку по стехиометрии реакции (2. 1) N S = N B и по исходным условиям ρВ = ρS, то объем образовавшегося продукта S равен объему превращенного реагента В. Следовательно, размер зерна в ходе процесса остается неизменным и F R постоянная величина. Тогда (2.3) примет вид
 . (2.4)
. (2.4)
Скорость диффузии реагента А через элементарный слой продукта S толщиной dr по закону Фика
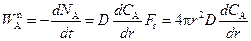 , (2.5)
, (2.5)
где D – коэффициент диффузии; dC A/ dr – градиент концентрации диффундирующего вещества; F r – поверхность, через которую происходит диффузия.
Скорость расходования реагента А при протекании химической реакции (2.I), согласно исходным условиям,
 , (2.6)
, (2.6)
где k f – поверхностная константа скорости реакции; F f – поверхность ФХР.
Для решения системы кинетических уравнений (2.4)—(2.6) в соответствии с условием (2.2) необходимо предварительно определить градиент dC A/ dr в уравнении (2.5). Будем исходить из упрощающего допущения о квазистационарности, согласно которому скорость диффузии через слой продукта S в ходе процесса постоянна, т. е.
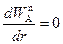 . (2.7)
. (2.7)
В действительности по мере увеличения толщины слоя продукта скорость диффузии уменьшается, однако и в этих условиях применение допущения (2.7) обосновано. С учетом уравнения (2.5) условие (2.7) примет вид
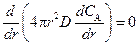 . (2.8)
. (2.8)
Для решения уравнения (2.8) необходимо учесть условия на границах слоя продукта (см. рис. 2.1):
|
|
|
 . (2.9)
. (2.9)
Для удобства дальнейших преобразований перейдем к безразмерному радиусу z = r / R. Тогда выражение (2.8) и условия (2.9) примут вид
 ; (2.10)
; (2.10)
 . (2.11)
. (2.11)
Из уравнения (2.10) следует, что
 . (2.12)
. (2.12)
Проинтегрировав (2.12), получим  .
.
Постоянные интегрирования А и В определяются из граничных условий (2.11):
 (2.13)
(2.13)
Решив систему (2.13), найдем, что
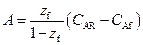 ,
,
и тогда искомый градиент 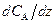 из уравнения (2.12) будет определяться выражением
из уравнения (2.12) будет определяться выражением
 . (2.14)
. (2.14)
С введением полученного выражения (2.14) и безразмерного радиуса z, система кинетических уравнений (2.4)—(2.6) примет вид
 (2.15)
(2.15)
Обозначив
 (2.16)
(2.16)
в соответствии с условием (2.2) получим следующее математическое описание стационарного протекания процесса
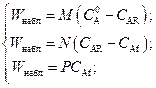 (2.17)
(2.17)
Решив систему (2.17), получим концентрации вблизи внешней поверхности C АR и вблизи фронта химической реакции С Аf, недоступные непосредственному измерению в обычных экспериментах, а также искомую наблюдаемую скорость химического превращения W набл:
 ; (2.18)
; (2.18)
 ; (2.19)
; (2.19)
 . (2.20)
. (2.20)
Выражение скорости W набл определяется как функция единственной переменной – безразмерного радиуса фронта химической реакции z f:
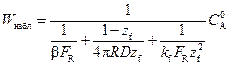 (2.21)
(2.21)
Для анализа и расчетов удобнее иметь связь скорости процесса со степенью превращения твердого реагента х В. Найдем соотношение между z f и х В. Исходя из того что количество моль вещества В в ядре зерна объемом V В составляет N В = ρВ V В, при исходном условии постоянства мольной плотности ρВ получим
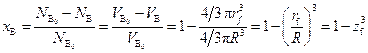 ,
,
откуда 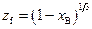 , (2.22)
, (2.22)
и искомая связь  , согласно (2.21), примет вид
, согласно (2.21), примет вид
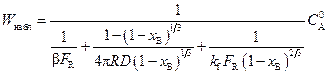 , (2.23)
, (2.23)
или  .
.
Постоянную величину 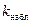 можно рассматривать как наблюдаемую константу скорости процесса: тогда сумма членов в знаменателе выражения (2.23) будет определять общее сопротивление процессу со стороны всех стадий – общее торможение скорости процесса. Анализ знаменателя показывает, что в ходе процесса по мере увеличения степени превращения х В сопротивление со стороны стадии внешней диффузии (внешнедиффузионное торможение) при неизменном размере зерна остается постоянным. Сопротивление со стороны стадии диффузии через слой продукта (диффузионное торможение слоем продукта) и со стороны химической реакции возрастает, но в разной степени. Таким образом, при постоянстве наблюдаемой скорости процесса в стационарных условиях изменяется относительная значимость сопротивлений отдельных стадий. Такое перераспределение может привести к изменению роли отдельных стадий в ходе химического процесса.
можно рассматривать как наблюдаемую константу скорости процесса: тогда сумма членов в знаменателе выражения (2.23) будет определять общее сопротивление процессу со стороны всех стадий – общее торможение скорости процесса. Анализ знаменателя показывает, что в ходе процесса по мере увеличения степени превращения х В сопротивление со стороны стадии внешней диффузии (внешнедиффузионное торможение) при неизменном размере зерна остается постоянным. Сопротивление со стороны стадии диффузии через слой продукта (диффузионное торможение слоем продукта) и со стороны химической реакции возрастает, но в разной степени. Таким образом, при постоянстве наблюдаемой скорости процесса в стационарных условиях изменяется относительная значимость сопротивлений отдельных стадий. Такое перераспределение может привести к изменению роли отдельных стадий в ходе химического процесса.
|
|
|
Для анализа протекания процесса, определения путей его интенсификации и практических расчетов нужно знать время, необходимое для достижения заданной степени превращения твердого реагента х В. Найти его можно из уравнения движения фронта химической реакции, поскольку скорость движения фронта химической реакции непосредственно связана со скоростью расходования реагента В
 . (2.24)
. (2.24)
По стехиометрии реакции и с учетом (2.15 – последнее уравнение), получим
 . (2.25)
. (2.25)
Из зависимостей (2.24) и (2.25) найдем уравнение движения фронта химической реакции в ходе процесса
 .
.
Подстановкой выражения (2.19) с учетом обозначения (2.16) получим
 . (2.26)
. (2.26)
Интегрированием уравнения в пределах по времени от нуля до t и по положению фронта химической реакции от 1 до z f найдем
 .
.
С учетом (2.22) получим искомое уравнение, определяющее время, необходимое для достижения заданной степени превращения х В

 (2.27)
(2.27)
Уравнение (2.27) получено при условии, что к моменту образования сплошного слоя твердого продукта степень превращения реагента х В еще пренебрежимо мала. Это справедливо в области высоких температур.
Процесс заканчивается, когда весь реагент В превратится в продукт S, т.е. при х В = 1. Время полного превращения составит
 , (2.28)
, (2.28)
где t п1, t п2 и t п3 – характерное время, определяющее вклады соответственно внешней диффузии, диффузии через слой продукта и химической реакции в полную длительность процесса.
Примем допущение о наличии лимитирующей стадии, что упростит практическое использование и анализ уравнений (2.23) и (2.27).
Лимитирующая стадия – внешняя диффузия. Процесс протекает во внешнедиффузионной области. В соответствии с условием существования лимитирующей стадии  и
и 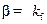 . При этом в соответствии с (2.16)
. При этом в соответствии с (2.16) 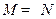 и
и  . Анализ выражений (2.18)–(2.20) для этого случая показывает, что
. Анализ выражений (2.18)–(2.20) для этого случая показывает, что
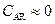 ;
;  ;
;
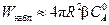 . (2.29)
. (2.29)
Временные характеристики t и t п в соответствии с (2.27) и (2.28) примут вид
|
|
|
 ;
;  . (2.30)
. (2.30)
Относительное время контакта Г и Т, необходимое для достижения данной х В, составляет
 . (2.31)
. (2.31)
Анализ полученных выражений приводит к выводам о том, что: 1) наблюдаемая скорость химического превращения определяется скоростью внешней диффузии; 2) при постоянстве концентрации газообразного реагент в ядре газового потока  возможно стационарное протекание процесса; 3) наблюдаемые во внешнедиффузионной области закономерности не связаны с кинетикой собственно топохимической реакции.
возможно стационарное протекание процесса; 3) наблюдаемые во внешнедиффузионной области закономерности не связаны с кинетикой собственно топохимической реакции.
Лимитирующая стадия – диффузия через слой твердого продукта. Процесс протекает в диффузионной области. В соответствии с условием существования лимитирующей стадии  и
и  . соответственно
. соответственно 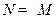 и
и  . Тогда из уравнений (2. 18)–(2.20) следует, что
. Тогда из уравнений (2. 18)–(2.20) следует, что
 ;
;  ;
;
 . (2.32)
. (2.32)
Временные характеристики примут вид
 ;
;  ; (2.33)
; (2.33)
 . (2.34)
. (2.34)
Анализ полученных выражений показывает, что: 1) наблюдаемая скорость химического превращения определяется скоростью диффузии через слой продукта; 2) даже при постоянстве  стационарное протекание процесса невозможно; с увеличением х В величина W набл медленно уменьшается во времени; 3) наблюдаемые закономерности не зависят от кинетики собственно топохимической реакции.
стационарное протекание процесса невозможно; с увеличением х В величина W набл медленно уменьшается во времени; 3) наблюдаемые закономерности не зависят от кинетики собственно топохимической реакции.
Лимитирующая стадия – химическая реакция. Процесс протекает в кинетической области. В соответствии с условием существования лимитирующей стадии 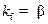 и
и  ; тогда
; тогда 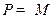 и
и  . С учетом этого из уравнений (2.18)–(2.20) следует
. С учетом этого из уравнений (2.18)–(2.20) следует
 ;
;  ;
;
 . (2.35)
. (2.35)
Временные характеристики будут определяться уравнениями
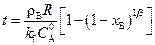 ;
;  ; (2.36)
; (2.36)
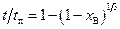 . (2.37)
. (2.37)
Анализ полученных выражений свидетельствует, что: 1) наблюдаемая скорость химического превращения определяется скоростью химической реакции; 2) как и в предыдущем случае, даже при постоянстве  стационарное протекание процесса невозможно; с увеличением х В величина W набл уменьшается во времени; 3) только в кинетической области наблюдаемые закономерности определяются кинетикой собственно топохимической реакции.
стационарное протекание процесса невозможно; с увеличением х В величина W набл уменьшается во времени; 3) только в кинетической области наблюдаемые закономерности определяются кинетикой собственно топохимической реакции.
Для применения полученных математических описаний различных областей протекания процесса необходимо определение его лимитирующей стадии.
Определение лимитирующей стадии. Обычно лимитирующую стадию и, следовательно, область протекания процесса определяют по различным экспериментальным зависимостям. Важнейшим экспериментальным критерием, определяющим область внешней диффузии, является четкая зависимость наблюдаемой скорости химического превращения от линейной скорости газового потока при относительно слабой чувствительности к температуре (рис. 2.2). Таким образом, область внешней диффузии наблюдается при низких линейных скоростях газового потока и высокой температуре. Если процесс протекает по схеме, представленной на рис. 2.1, то для определения лимитирующей стадии можно использовать зависимость степени превращения х В от временной характеристики  (рис. 2.3). Линейный характер экспериментальной зависимости
(рис. 2.3). Линейный характер экспериментальной зависимости 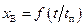 свидетельствует о том, что процесс лимитируется стадией внешней диффузии. Если при достаточно высокой температуре, обеспечивающей отсутствие внешне-диффузионной и кинетической областей, установленная экспериментальная зависимость
свидетельствует о том, что процесс лимитируется стадией внешней диффузии. Если при достаточно высокой температуре, обеспечивающей отсутствие внешне-диффузионной и кинетической областей, установленная экспериментальная зависимость 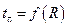 близка к виду
близка к виду
|
|
|
 ,
,
то лимитирующей стадией, согласно (2.33), является диффузия через слой продукта. Характерным признаком кинетической области является резкая экспоненциальная зависимость W набл от температуры; обычно она наблюдается при низких температурах проведения процесса.

Рис. 2.2. Определение лимитирующей стадии процесса и системе Г–Т по наблюдаемой зависимости процесса Wнабл от линейной скорости газового потока (а) и от температуры (б):
1—3 – соответствии» внешнедиффузионная переходная и кинетическая области.
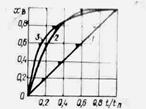
Рис. 2.3. Зависимость степени превращения твердого реагента от относительного времени контакта при различных лимитирующих стадиях:
1 – внешняя диффузия (уравнение (2.33)); 2 – диффузия через слой продукта (2.36); 3 – химическая реакция (2.39).
Полученные уравнения (2.29)–(2.37) вследствие их простоты широко применяются в практических расчетах. Однако для их правильного использования необходимо учитывать возможный по мере увеличения х В переход процесса из одной области протекания в другую даже при сохранении постоянных концентрации газообразного реагента и температуры. Как показал анализ уравнения (2.23), такой переход может иметь место при перераспределении сопротивлений отдельных стадий в ходе процесса. Таким образом, частные математические описания (2.30), (2.33) и (2.36) могут оказаться справедливыми лишь в определенном диапазоне х В, в то время как математическое выражение (2.27) описывает процесс во всем возможном диапазоне х В.
В заключение отметим следующие характерные особенности кинетики химических процессов с участием твердой фазы: 1) наличие большого числа макростадий различной природы; 2) ограниченность реакционной зоны поверхностью раздела фаз твердый реагент – твердый продукт реакции; 3) образование и изменение реакционной поверхности в ходе процесса; 4) изменение условий тепломассопереноса в результате перемещения фронта химической реакции; 5) возможность перехода процесса из одной области протекания в другую. В связи с этим кинетический анализ процессов с топохимическими реакциями относится к одной из наиболее сложных задач макрокинетики.
Протекание химических процессов в системе Г – Т может сопровождаться явлениями воспламенения и возникновения стефановского потока. Кратко охарактеризуем их.
Выделяющаяся при протекании экзотермических реакций теплота частично уносится газовым потоком. Поэтому при незначительном тепловом эффекте разогрев реакционной зоны несущественный. Для сильно экзотермических реакций перепад температур в реакционной зоне и в ядре газового потока может достигать больших значений. Разогрев реакционной поверхности приводит к резкому увеличению скорости реакции по экспоненциальному закону (см. рис. 2.2, б). При этом могут создаться условия, при которых скорость тепловыделения в результате реакции будет превышать скорость теплоотвода с газовым потоком. В этих условиях дальнейшее повышение температуры вызовет самопроизвольный прогрессирующий разогрев поверхности – воспламенение.
Если реакция протекает по схеме

с изменением объема (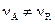 ), то возникает перемещение масс газа, называемое стефановским потоком. Оно существенно влияет на ход процесса: при уменьшении объема (
), то возникает перемещение масс газа, называемое стефановским потоком. Оно существенно влияет на ход процесса: при уменьшении объема ( ) стефановский поток направлен к фронту химической реакции и ускоряет процесс, при увеличении объема (
) стефановский поток направлен к фронту химической реакции и ускоряет процесс, при увеличении объема ( ) – стефановский поток направлен от фронта химической реакции к внешней поверхности и тормозит процесс.
) – стефановский поток направлен от фронта химической реакции к внешней поверхности и тормозит процесс.
|
|
|


