 |
Методики аналитического контроля
|
|
|
|
1.Определение жесткости
В коническую колбу вместимостью 250 мл отмеривают 100 мл исследуемой воды, добавляют 5 мл аммиачного буферного раствора и 7…8 капель индикатора – хром кислотный темно-синий. При этом раствор окрашивается в розовый цвет и его сразу же титруют 0,1 н раствором трилона Б при интенсивном перемешивании до изменения розовой окраски в синюю. Замечают по делениям бюретки объем раствора трилона Б, затраченного на титрование.
Если на титрование затрачено больше 10 мл раствора трилона Б, то опыт следует повторить, взяв для определения меньший объем пробы (50 мл) и довести пробу до 100 мл дистиллированной водой.
Общая жесткость вычисляется по формуле, мг-экв/кг
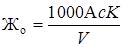
где с – нормальность раствора трилона Б;
K – поправочный коэффициент к нормальности раствора трилона Б;
А – объем раствора трилона Б, мл;
V – объем анализируемой пробы, мл.
2.Определение концентрации ионов кальция
В коническую колбу вместимостью 250 мл отмеряют 100 мл исследуемой пробы, или меньший объем, разбавленный до 100 мл, добавляют 2 мл 2н раствора NaOH и 10…15 мг сухой смеси индикатора мурексида, титруют 0,1 н раствором трилона Б при энергичном помешивании до перехода малиновой окраски в сине-фиолетовую. Замечают по делениям бюретки объем раствора, затраченного на титрование. Содержание ионов кальция или кальциевую жесткость рассчитывают по формуле, мг-экв/кг
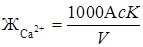
где с – нормальность раствора трилона Б;
К – поправочный коэффициент к нормальности раствора трилона Б;
А – объем раствора трилона Б, мл;
V – объем анализируемой пробы, мл.
3.Определение щелочности воды.
В коническую колбу вместимостью 250 мл отбирают 100 мл исследуемой воды, добавляют 2-3 капли индикатора фенолфталеина. В случае появления розового окрашивания пробу титруют 0,1 н раствором HCl до обесцвечивания. Расход кислоты при титровании с фенолфталеином записывают, обозначив его через Ф. Затем в ту же самую пробу добавляют 2-3 капли индикатора метилового - оранжевого и продолжают титровать 0,1н раствором HCl до момента перехода желтой окраски в оранжевую. Суммарный расход кислоты при титровании с фенолфталеином и метиловым оранжевым обозначают М.
|
|
|
Общую щелочность воды подсчитывают по формуле, мг-экв/кг

где М – общий расход кислоты при титровании с фенолфталеином и с метиловым оранжевым, мл;
с – нормальность раствора HCl;
V – объем анализируемой пробы, мл.
Подсчет отдельных форм щелочности ведут в соответствии с полученными при титровании данными. Возможны следующие случаи:
1) фенолфталеин не дает розового окрашивания, Ф=0. В этом случае в воде присутствуют только бикарбонаты (бикарбонатная щелочность),
Щбикарб = М;
2) фенолфталеин дает розовое окрашивание, причем 2Ф<М. В этом случае в воде присутствуют как бикарбонаты, так и карбонаты.
При этом Щбикарб = (М–2Ф); Щкарб = 2Ф;
3) фенолфталеин дает розовое окрашивание, причем 2Ф = М. В этом случае в воде присутствуют только карбонаты, Щкарб = 2Ф;
4) фенолфталеин дает розовое окрашивание, причем 2Ф>М. В этом случае в воде присутствуют карбонаты и гидраты:
Щкарб = 2(М–Ф); Щгидр = (2Ф–М);
5) фенолфталеин дает розовое окрашивание, причем Ф = М (после обесцвечивания фенолфталеина прибавление метилового оранжевого сразу вызывает оранжевую окраску раствора). В этом случае присутствуют только гидраты, Щгидр = М.
4. Определение перманганатной окисляемости
Перманганатная окисляемость является условной характеристикой степени загрязненности воды органическими веществами. 
 В коническую колбу вместимостью 250 мл отмеривают 50 мл исследуемой воды, прибавляют 50 мл дистиллированной воды (объем пробы уточняет преподаватель), затем вводят 10мл 10н Серной кислоты и прибавляют из бюретки точно 10 мл 0,01 н. раствора перманганата. Раствор в колбе из термостойкого стекла нагревают на электрической плитке до кипения и кипятят в течение 10 мин. При этом происходит окисление содержащихся в воде органических примесей за счет восстановления перманганата (окрашенный ион MnO4- переходит в бесцветный ион Mn2+).
В коническую колбу вместимостью 250 мл отмеривают 50 мл исследуемой воды, прибавляют 50 мл дистиллированной воды (объем пробы уточняет преподаватель), затем вводят 10мл 10н Серной кислоты и прибавляют из бюретки точно 10 мл 0,01 н. раствора перманганата. Раствор в колбе из термостойкого стекла нагревают на электрической плитке до кипения и кипятят в течение 10 мин. При этом происходит окисление содержащихся в воде органических примесей за счет восстановления перманганата (окрашенный ион MnO4- переходит в бесцветный ион Mn2+).
|
|
|
При проведении анализа окисляемости необходимо определить избыток перманганата в растворе, который не был израсходован на окисление органических примесей. К горячему раствору из бюретки прибавляют точно 10 мл 0,01 н. раствора щавелевой кислоты. При этом должно произойти полное обесцвечивание раствора (щавелевая кислота является сильным восстановителем). Реакция протекает по уравнению
2KMnO4 + 5H2C2O4 + 3H2SO4® 2MnSO4 + K2SO4 + 8H2O+10CO2
Совершенно бесцветную жидкость при помешивании титруют 0,01 н. раствором перманганата калия до появления слабо-розовой окраски, не исчезающей в течение минуты. Последнее свидетельствует об окончании титрования, то есть о наличии незначительного избытка перманганата. Если при кипячении в течение 10 мин. Жидкость обесцветится, побуреет или в ней возникнет коричневый осадок, то определение следует повторить, взяв меньший объем анализируемой воды.1
Параллельно проводят контрольное определение, для чего к 100 мл дистиллированной воды в конической колбе вместимостью 250 мл добавляют 10 мл 10 н. серной кислоты, нагревают жидкость почти до кипения, вводят точно 10 мл 0,01 н. раствора перманганата, кипятят ровно 10 минут, считая с момента закипания, восстанавливают избыток перманганата 10 мл 0,01 н. раствором щавелевой кислоты и титруют обесцветившуюся жидкость 0,01 н. раствором перманганата до появления слабо-розовой окраски.
Величину перманганатной окисляемости вычисляют по формуле
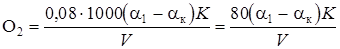 ,
,
где О2 – перманганатная окисляемость, мг О2/ кг;
a1, aк – расходы 0,01 н. раствора KMnO4 на титрование анализируемой и контрольной проб, мл;
К – коэффициент сантинормальности раствора перманганата калия, К =1 для точно 0,01 н. раствора;
V – объем анализируемой пробы, взятой для определения, мл;
0,08 – титр точно 0,01 н. раствора перманганата по кислороду, в случае определения окисляемости по перманганату в приведенной формуле множитель 0,08 заменяют на 0,326 (размерность окисляемости в этом случае мг KMnO4/кг).
|
|
|
Таблица 2. Измерение показателей качества водопроводной воды
| Показатель качества воды | Индикатор | Раствор для титрования | Расход раствора | Изменение окраски при титровании | Расчетная формула | Величина показателя качества |
| Запах 25оC 60оC | ||||||
| Жо | ||||||
| ЖCa 2+ | ||||||
| ЖMg 2+ | ||||||
| Жк | ||||||
| Жнк | ||||||
| Що | ||||||
| Щбк | ||||||
| Щк | ||||||
| Щг | ||||||
| рН | ||||||
| Окисляемость |
Таблица 3. Измерение показателей качества _______________________________ воды.
| Показатель качества воды | Индикатор | Раствор для титрования | Расход раствора | Изменение окраски при титровании | Расчетная формула | Величина показателя качества |
| Жо | ||||||
| ЖCa 2+ | ||||||
| ЖMg 2+ | ||||||
| Жк | ||||||
| Жнк | ||||||
| Що | ||||||
| Щбк | ||||||
| Щк | ||||||
| Щг | ||||||
| рН |
|
|
|


