 |
Раздел 3. Учение о растворах
|
|
|
|
Тема 1. Свойства разбавленных растворов
Методические указания
Коллигативные свойства – это свойства растворов, зависящие от числа частиц растворенного вещества. К коллигативным свойствам растворов относят:
1) понижение давления насыщенного пара растворителя над раствором;
2) понижение температуры замерзания и повышение температуры кипения растворов по сравнению с температурами замерзания и кипения чистых растворителей;
3) осмотическое давление.
1. Понижение давления пара растворителя над раствором, Δр (I закон Рауля): понижение давления насыщенного пара растворителя над раствором пропорционально молярной доле растворенного вещества.
Математическое выражение: Р0–Р = Р0·χ,
где Р0 – давление насыщенного пара растворителя над чистым растворителем,
Р – давление насыщенного пара растворителя над раствором,
χ- молярная доля растворенного вещества.
χ = n2 /n1 + n2
n1 – количество растворителя; n2 – количество растворенного вещества, моль.
Если обозначить (Р0–Р) через ΔР, получим:
Р0–Р/Р0 = ΔР/Р0. Это отношение называют относительным понижением давления насыщенного пара растворителя над раствором: ΔР/Р0 = χ
2. Растворы замерзают при более низкой температуре, чем чистый растворитель, что является следствием понижения давления пара растворителя над раствором. Понижение температуры кристаллизации раствора:
∆Т зам. = То - Т = Ккр. Сm (В),
где ∆Т зам. – понижение температуры замерзания раствора, К;
К кр. – криоскопический коэффициент, К · кг · моль– 1;
Сm (В) – моляльная концентрация вещества В, моль/кг.
Если в массе растворителя m А находится m В грамм вещества В, то:  ,
,
где m B – масса растворенного вещества В, г;
|
|
|
М В – молярная масса растворенного вещества В, г/моль;
m A – масса растворителя, г.
Тогда уравнение можно записать в виде:

и использовать его для экспериментального определения и расчета молярной массы неизвестного вещества по понижению температуры замерзания его раствора в известном растворителе: 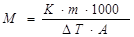
3. Жидкость кипит при той температуре, при которой давление насыщенного пара над ней достигает внешнего давления. С ростом в ней концентрации растворенного нелетучего вещества давление пара растворителя над раствором понижается и раствор кипит при более высокой температуре, чем чистый растворитель. Повышение температуры кипения от Т о для чистого растворителя до Т для разбавленных растворов рассчитывают с помощью следующего уравнения:
∆Т кип. = Т – Т о = Кэб. С m(В),(I)
где ∆Т кип. – повышение температуры кипения раствора, К;
Кэб. – эбулиоскопический коэффициент, К · кг · моль– 1;
Сm(В) - моляльная концентрация вещества В, моль/кг.

где m B – масса растворенного вещества В, г;
М В – молярная масса растворенного вещества В, г/моль;
m A – масса растворителя, г.
4. Осмос обусловлен стремлением системы к термодинамическому равновесию и выравниванию концентраций растворов по обе стороны мембраны путем односторонней диффузии молекул растворителя. Осмотическое давление - давление, производимое молекулами растворенного вещества на полупроницаемые стенки сосуда.
Осмотическое давление, Р, кПа:
P = CмRT.
Cм – молярная концентрация, моль/л;
R – газовая постоянная [8,31 Дж/(моль·К)];
Т – температура, К.

Если растворенное вещество распадается в растворе на ионы, то увеличение числа частиц за счет диссоциации его молекул учитывается через введение изотонического коэффициента i
∆Т зам. = i Ккр.Сm; ∆Т кип. = i Кэб.С m ; P = iCмRT
Изотонический коэффициент связан со степенью диссоциации:
i = 1 + (n – 1) α, где n – число ионов, на которые диссоциирует электролит.
|
|
|
è Решение типовых задач
Пример 1. В 1000 воды растворено 100г сахарозы. Молярная масса сахарозы М=342 г/моль. Определите температуру кипения раствора.
Решение: 
Отсюда температура кипения раствора равна:
Т = 373 + 0,146 = 378,146 К
или t=100о+0,146=100,146оС
Ответ: Т=378,146 К
Пример 2. Раствор, содержащий 8 г некоторого вещества в 100 г диэтилового эфира, кипит при 36,86 °С, тогда как чистый эфир кипит при 35,6 °С. Определить молекулярную массу растворенного вещества.
Решение. Из условия задачи находим:
∆tкип = 36,86º – 35,6º = 1,26º.
Из уравнения ∆tкип = Кэб.·С m определяем моляльность раствора:1,26 = 2,02Сm;
Сm = 1,26 / 2,02 = 0,624 моля на 1000 г эфира.
Из условия задачи следует, что в 1000 г растворителя находится 80 г растворенного вещества. Поскольку эта масса соответствует 0,624 моль, то молярную массу вещества найдем из соотношения
80 г - 0,624 моль
Х г - 1 моль
М = 80 / 0,624 = 128,2 г/моль.
Ответ: Молекулярная масса растворенного вещества равна 128,2 г/моль.
Пример 3. Раствор, содержащий 0,85 г хлорида цинка в 125 г воды, кристаллизуется при t = – 0,23 °С. Определить кажущуюся степень диссоциации ZnCl2.
Решение. Находим моляльную концентрацию Сm соли в растворе. Молярная масса ZnCl2 равна 136 г/моль,
Сm = 0,85 · 1000 / (136·125) = 0,050 моль/кг.
Из уравнения DТ зам. = i Ккр. Сm находим изотонический коэффициент:
i = DТ зам / Ккр.· Сm = 0,23/ 1,86·0,05 = 2,47
Из уравнения i = 1 + (n – 1) α находим степень диссоциации: α = (i – 1) / (n – 1)
Так как при диссоциации 1 моль ZnCl2 образуется 3 моль-ионов: ZnCl2 ↔ Zn2+ + 2 Cl- , то n = 3.
Тогда α = (2,47 – 1) / (3 – 1) = 0,735.
Ответ: степень диссоциации соли равна 0,735 или 73,5%.
! Задачи для самостоятельной работы
* - при решении задач этого раздела использовать данные приложения 4.
1. Вычислите моляльную концентрацию водного раствора сахара С12Н22О11, зная температуру кристаллизации раствора (–0,930С).
2. Вычислите температуру кипения 5%-ного раствора нафталина С10Н8 в бензоле. Температура кипения бензола 80,20С.
3. Водный раствор, содержащий 5,18 г растворенного вещества в 155,18 г раствора, замерзает при температуре -1,390С. Вычислите молекулярную массу растворенного вещества.
4. При какой температуре будет кристаллизоваться 40%-ный водный раствор этилового спирта С2Н5ОН?
|
|
|
5. В каком отношении должны находиться массы воды и этилового спирта, чтобы при их смешении получить раствор, кристаллизующийся при – 200С?
6. В радиатор автомобиля налили 9 л воды и прибавили 2 л метилового спирта (ρ = 0,8 г/мл). При какой наименьшей температуре можно после этого оставлять автомобиль на открытом воздухе, не опасаясь, что вода в радиаторе замерзнет?
7. Водно-спиртовой раствор, содержащий 15% спирта, кристаллизуется при –10,260С. Найти молекулярную массу спирта.
8. Температура кипения водного раствора сахарозы С12Н22О11 равна 101,40С. Вычислить моляльную концентрацию и массовую долю сахарозы в растворе. При какой температуре замерзает этот раствор?
9. При какой температуре будет кристаллизоваться 14,6%-ный водный раствор сахара С12Н22О11?
10. Определить температуру кипения водного раствора глицерина с концентрацией 6,45%.
11. Водный раствор метанола имеет концентрацию растворенного вещества 4,85%. При какой температуре будет кристаллизоваться данный раствор?
12. Водный раствор этилового спирта кристаллизуется при температуре –270С. Какова процентная концентрация (по массе) этого раствора?
13. Смешаны вода и этиловый спирт в массовом соотношении 2:1. При какой температуре будет кристаллизоваться этот раствор?
14. Какой объем метилового спирта (ρ = 0,8 г/мл) нужно добавить к 9 л воды, чтобы полученный раствор не замерзал до –80С?
15. Вычислить температуру замерзания раствора нитрата серебра, содержащего 1 г соли и 50 г воды, если кажущаяся степень диссоциации равна 59%.
16. При растворении гидроксида натрия массой 12 г в воде массой 100 г температура кипения повысилась на 2,65°С. Какая степень диссоциации NaOH соответствует этим данным?
17. Чему равно при 17 °С осмотическое давление раствора, содержащего CaCl2 массой 11,2 г в растворе объемом 200 мл, если изотонический коэффициент раствора равен 2,5?
18. Раствор, содержащий 0,834 г сульфата натрия в 1000 г воды, замерзает при минус 0,0280С. Вычислить кажущуюся степень диссоциации сульфата натрия в растворе.
19. Осмотическое давление раствора, объем которого 3 л, при 10 °С равно 1,2 105 Па. Какова молярная концентрация этого раствора?
|
|
|
20. Раствор, содержащий 4,2 г KОН в 500 г воды, замерзает при – 0,519 °С. Найти изотонический коэффициент для этого раствора.
|
|
|


