 |
Первое следствие.
|
|
|
|
Тепловой эффект реакции (энтальпия реакции) равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ с учетом их стехиометрических коэффициентов:
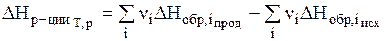 . ( 2 )
. ( 2 )
Это следствие позволяет вычислить энтальпии различных реакций (в том числе и биохимических, осуществление которых in vitro невозможно), используя табличные значения стандартных энтальпий образования продуктов реакции и исходных веществ.
Второе следствие.
Тепловой эффект реакции (энтальпия реакции) равен разности между суммой энтальпий сгорания исходных веществ и суммой энтальпий сгорания продуктов с учетом их стехиометрических коэффициентов:
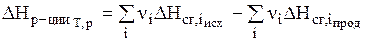 . ( 3 )
. ( 3 )
Третье следствие, известное также как закон Лавуазье – Лапласа.
Тепловой эффект образования соединения из данных веществ равен взятому с обратным знаком тепловому эффекту разложения данного соединения при этих же условиях до тех же исходных веществ.
DН0обр = -DН0cг. ( 4 )
Из закона Гесса также следует, что неизвестная энтальпия реакции может быть получена путем алгебраического суммирования известных энтальпий соответствующим образом подобранных химических реакций.
Первый закон термодинамики и вытекающие из него законы термохимии позволяют составить энергетический баланс термодинамического процесса, но не позволяют сделать заключение о возможности и направлении химического процесса и состоянии равновесия.
Второй закон термодинамики позволяет судить о направлении самопроизвольных процессов и совместно с первым началом устанавливает множество точных количественных соотношений между различными макроскопическими параметрами систем в состоянии термодинамического равновесия.
|
|
|
Процессы, происходящие в определенном направлении без затрат энергии из внешней среды и завершающиеся установлением состояния равновесия, называют самопроизвольными (например, взрыв, коррозия, разряд аккумулятора). Несамопроизвольные процессы (например, заряд аккумулятора) требуют подвода энергии из внешнего источника.
Процессы, протекающие в реальной жизни, являются самопроизвольными и необратимыми. Обратимый процесс (равновесный процесс, который может возвратиться в первоначальное состояние без каких-либо энергетических изменений в окружающей среде или в самой системе под влиянием бесконечно малой силы) является идеализацией.
Во всех необратимых процессах осуществляется более равномерное распределение энергии и вещества, происходит выравнивание в системе температур и других интенсивных параметров. Разупорядоченность, или степень беспорядка системы может быть определена количественно и называется энтропией. Эту функцию ввел Клаузиус и обозначил буквой S. Подобно энтальпии энтропия является экстенсивным свойством системы и функцией состояния системы. Поэтому изменении энтропии в ходе химической реакции может быть найдено в соответствии с первым следствием из закона Гесса: 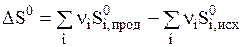 . ( 2 )
. ( 2 )
Формулировки второго начала термодинамики:
- Теплота не может самопроизвольно переходить от более холодного тела к более горячему (Клаузиус).
- Теплота наименее нагретого из тел системы не может служить источником работы, т. е. невозможно превращение только теплоты в работу, тогда как превращение работы в теплоту может быть единственным результатом процесса (Томсон).
- В изолированной системе самопроизвольные (необратимые) процессы происходят в направлении увеличения энтропии системы: dS > 0.
|
|
|
В случае открытых и закрытых систем энтропия не может быть критерием направленности процесс, т. к. кроме изменений в системе, необходимо учитывать изменения в окружающей среде. А это далеко не всегда возможно.
Для таких систем были введены специальные функции состояния, по изменению которых можно судить о направлении самопроизвольного процесса – термодинамические потенциалы.
В зависимости от системы и процесса роль термодинамического потенциала выполняют различные функции:
в изолированной системе (U=const и V=const) – энтропия;
изотермо- изобарный процесс - энергия Гиббса (G);
изотермо- изохорный процесс - энергия Гельмгольца (F);
при S=const и V=const - внутренняя энергия (U);
при S=const и p=const - энтальпия (H).
Термодинамические потенциалы являются критериями направления процесса: в ходе самопроизвольного процесса соответствующий термодинамический потенциал при постоянстве естественных переменных убывает: ∆ US, V < 0; ∆ HS, p < 0; ∆ AT, V < 0; ∆ Gp, T < 0, (энтропия – возрастает ∆ SU, V > 0). При этом потенциал стремится к некоему экстремальному значению: энтропия – к максимуму, все остальные – к минимуму, которому соответствуют равновесное состояние системы. В состоянии равновесия изменения всех потенциалов становиться равным нулю.
Для процессов, происходящих на Земле и в живых организмах, наибольшее значение имеет изотермо-изобарный потенциал – энергия Гиббса. Биохимические реакции, сопровождающиеся уменьшением энергии Гиббса, называются экзэргоническими реакциями, они могут совершаться самопроизвольно. Биохимические реакции, сопровождающиеся увеличением энергии Гиббса, называются эндэргоническими, и они не возможны без внешнего подвода энергии. Например, процесс фотосинтеза в растениях идет только под воздействием солнечной энергии. В живых организмах эндэргонические реакции происходят за счет их сопряжения с экзэргоническими реакциями.
Рассчитать стандартную энергию Гиббса можно по уравнениям:
1) Уравнение изотермы: ∆ G0 = -RTlnKp.
2) Следствие из закона Гесса:
∆ G0298 = å (ni∆ G0i)прод - å (ni∆ G0i)реаг.
3) Уравнение Гиббса – Гельмгольца: ∆ G0 = ∆ Н0 - Т∆ S0 (при условии, что все составляющие уравнения взяты при одинаковой температуре).
|
|
|


