 |
Буферные системы. Кислотно-основное состояние
|
|
|
|
БУФЕРНЫЕ СИСТЕМЫ. КИСЛОТНО-ОСНОВНОЕ СОСТОЯНИЕ
Буферными называют растворы, способные сохранять значение рН при разбавлении или добавлении небольших количеств кислоты или щелочи. К таким растворам относят:
1) Растворы, содержащие слабую кислоту и соль этой кислоты и сильного основания (СН3СООН + СН3СООNa);
2) Растворы, содержащие слабое основание и соль этого основания и сильной кислоты (NH4OH + NH4Cl);
3) Растворы, содержащие соли многоосновных кислот (Na2HPO4 + NaH2PO4).
Расчет рН буферного раствора
Расчета рН буферных растворов осуществляется по уравнению Гендерсона – Гассельбаха:
– для кислотного буфера уравнение имеет вид
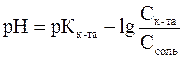 .
.
– для основного буфера
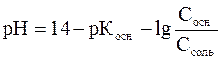
Уравнения показывают, что рН буферного раствора данного состава определяется отношением концентраций кислоты и соли или основания и соли, поэтому не зависит от разбавления. При изменении объема раствора концентрация каждого компонента изменяется в одинаковое число раз.
Буферная емкость
Способность буферных растворов сохранять постоянство рН ограничена. Т. е. прибавлять кислоту или щелочь, существенно не меняя рН буферного раствора, можно лишь в ограниченных количествах.
Величину, характеризующую способность буферного раствора противодействовать смещению реакции среды при добавлении кислот и щелочи, называют буферной ёмкостью раствора (В).
Буферная ёмкость измеряется количеством молей эквивалентов сильной кислоты или щелочи, добавление которой к 1 л буферного раствора изменяет рН на единицу.
|
|
|
Математически буферная ёмкость определяется следующим образом:
В по кислоте (моль/л ил ммоль/л):
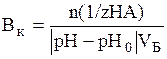 ,
,
где n(1/z HA) – количество моль эквивалентов кислоты, рН0 и рН – рН буферного раствора до и после добавления кислоты, VБ – объем буферного раствора.
В по щелочи (моль/л или ммоль/л):
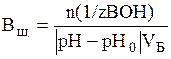 ,
,
где n (1/z ВОН) – количество моль эквивалентов щелочи, остальные обозначения те же.
Буферная ёмкость зависит от ряда факторов:
1. От природы добавляемых веществ и компонентов буферного раствора. Т. к. некоторые вещества могут образовывать нерастворимые соединения или комплексы или давать другие нежелательные реакции с компонентами буферной системы, тогда понятие буферной ёмкости теряет смысл.
2. От исходной концентрации компонентов буферной системы.
Чем больше количества компонентов кислотно-основной пары в растворе, тем больше буферная ёмкость этого раствора.
Предел соотношения концентраций компонентов буферного раствора, при котором система все еще сохраняет свои свойства. Интервал рН = рК ± 1, называется зоной буферного действия системы. Это соответствует интервалу соотношения Ссоли/Ск-ты от 1/10 до 10/1.
Вк (крови) = 0, 05моль/л; Вк (плазмы) = 0, 03 моль/л; Вк (сыв. крови) = 0, 025 моль/л
Буферные системы крови
Особенно большое значение буферные системы имеют в поддержании кислотно-основного равновесия организмов. Значение рН большей части внутриклеточных жидкостей находится в интервале от 6, 8 до 7, 8.
Кислотно – основное равновесие в крови человека обеспечивается гидрокарбонатной, фосфатной, белковой и гемоглобиновой буферными системами. Нормальное значение рН плазмы крови 7, 40 ± 0, 05.
Гемоглобиновая буфернаясистемана 35% обеспечивает буферную емкость крови:  . Оксигемоглобин является более сильной кислотой, чем восстановленный гемоглобин. Оксигемоглобин обычно бывает в виде калиевой соли.
. Оксигемоглобин является более сильной кислотой, чем восстановленный гемоглобин. Оксигемоглобин обычно бывает в виде калиевой соли.
|
|
|
Карбонатная буферная система: 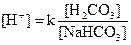 по своей мощности занимает первое место. Она представлена угольной кислотой (Н2СО3) и бикарбонатом натрия или калия (NaНСО3, КНСО3) в пропорции 1/20. Бикарбонатный буфер широко используется для коррекции нарушений кислотно-основного состояния организма.
по своей мощности занимает первое место. Она представлена угольной кислотой (Н2СО3) и бикарбонатом натрия или калия (NaНСО3, КНСО3) в пропорции 1/20. Бикарбонатный буфер широко используется для коррекции нарушений кислотно-основного состояния организма.
Фосфатная буферная система 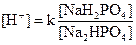 . Дигидрофосфатобладает свойствами слабой кислоты и взаимодействует с поступившими в кровь щелочными продуктами. Гидрофосфат имеет свойства слабой щелочи и вступает в реакцию с более сильными кислотами.
. Дигидрофосфатобладает свойствами слабой кислоты и взаимодействует с поступившими в кровь щелочными продуктами. Гидрофосфат имеет свойства слабой щелочи и вступает в реакцию с более сильными кислотами.
Белковая буферная системаосуществляет роль нейтрализации кислот и щелочей благодаря амфотерным свойствам: в кислой среде белки плазмы ведут себя как основания, в основной – как кислоты: 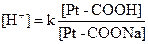
Буферные системы имеются и в тканях, что способствует поддержанию рН тканей на относительно постоянном уровне. Главными буферами тканей являются белки и фосфаты. Поддержание рН осуществляется также с помощью легких и почек. Через легкие удаляется избыток углекислоты. Почки при ацидозе выделяют больше кислого одноосновного фосфата натрия, а при алкалозе – больше щелочных солей: двухосновного фосфата натрия и бикарбоната натрия.
|
|
|


