 |
2.2.2.1 Многовариантное задание № 6 «Анализ фазовых равновесий жидкость – пар в двухкомпонентной системе»
|
|
|
|
2. 2. 2. 1 Многовариантное задание № 6 «Анализ фазовых равновесий жидкость – пар в двухкомпонентной системе»
1. Какую информацию о системе несет диаграмма температура кипения – состав заданной в таблице 2. 5 системы A–B (рисунки 2. 8 – 2. 22)?
По диаграмме определите:
2. При какой температуре закипит жидкость, содержащая а % вещества A. .
3. При какой температуре вся первоначальная жидкость обратится в пар, если при нагревании пар не отводить?
4. Как будет меняться состав первоначальной жидкости по мере испарения?
5. Каков состав первых пузырьков пара?
6. Как изменяется состав равновесного с кипящей жидкостью пара в ходе испарения?
7. Какое количество каждого из компонентов смеси будет находиться в жидкой фазе и в паре, если m кг смеси заданного состава нагреть до температуры t )?
8. Какие продукты можно получить, если подвергнуть жидкость заданного состава:
а) перегонке в равновесии (интегральной перегонке);
б) простой (дифференциальной) перегонке;
в) ректификации?
Таблица 2. 5 – Варианты заданий
| Вариант | Система A–B | Масса исходной жидкости m, кг | Состав исходной жидкости и температура | |||||
| Подварианты | ||||||||
| aА, % | t, °C | aА, % | t, °C | aА, % | t, °C | |||
| H2O – C4H8O2 | 2, 0 | |||||||
| CH3OH – C2H4Cl2 | 0, 5 | |||||||
| CH3CN – H2O | 0, 8 | |||||||
| HNO3 – H2O | 1, 5 | |||||||
| C6H5CH3 – изо-C4H9OH | 1, 2 | |||||||
| HF – H2O | 0, 6 | |||||||
| C2H5OH – C2HCl3 | 1, 5 | |||||||
| HCOOH – H2O, p = 5, 33кПа | 0, 8 | |||||||
| H2O – HCOOH | 1, 4 | 106, 5 | ||||||
| C3H7OH – H2O | 5, 0 | |||||||
| C2H5OH – H2O | 2, 2 | |||||||
| C5H4O2 – H2O | 1, 5 | |||||||
| (C2H5)2O – CCl4 | 2, 0 | 72, 5 | ||||||
| изо-C3H7OH – H2O | 1, 2 | |||||||
| CH3COOH – H2O | 1, 3 | |||||||
| H2O – C4H8O2 | 1, 5 | |||||||
| CH3OH – C2H5Cl2 | 1, 0 | |||||||
| CH3CN – H2O | 1, 0 | |||||||
| HNO3 – H2O | 3, 0 | |||||||
| C6H5CH3 – изо-C4H9OH | 1, 5 | |||||||
| HF – H2O | 2, 5 | |||||||
| C2H5OH – C2HCl3 | 2, 0 | |||||||
| HCOOH – H2O, p = 5, 33кПа | 1, 2 | |||||||
| H2O – HCOOH | 1, 6 | 106, 5 | ||||||
| C3H7OH – H2O | 2, 5 | |||||||
| C2H5OH – H2O | 2, 0 | |||||||
| изо-С3H7OH – H2O | 2, 0 | |||||||
|
|
|
Продолжение таблицы 2. 5
| Вариант | Система A–B | Масса исходной жидкости m, кг | Состав исходной жидкости и температура | |||||
| Подварианты | ||||||||
| aА, % | t, °C | aА, % | t, °C | aА, % | t, °C | |||
| H2O – C4H8O2 | 2, 0 | |||||||
| CH3OH – C2H4Cl2 | 0, 5 | |||||||
| CH3CN – H2O | 0, 8 | |||||||
| HNO3 – H2O | 1, 5 | |||||||
| C6H5CH3 – изо-C4H9OH | 1, 2 | |||||||
| HF – H2O | 0, 6 | |||||||
| C2H5OH – C2HCl3 | 1, 5 | |||||||
| HCOOH – H2O, p = 5, 33кПа | 0, 8 | |||||||
| H2O – HCOOH | 1, 4 | 106, 5 | ||||||
| C3H7OH – H2O | 5, 0 | |||||||
| C2H5OH – H2O | 2, 2 | |||||||
| C5H4O2 – H2O | 1, 5 | |||||||
| (C2H5)2O – CCl4 | 2, 0 | 67, 5 | ||||||
| изо-C3H7OH – H2O | 1, 2 | |||||||
| CH3COOH – H2O | 1, 3 | |||||||
| H2O – C4H8O2 | 1, 5 | |||||||
| CH3OH – C2H5Cl2 | 1, 0 | |||||||
| CH3CN – H2O | 1, 0 | |||||||
| HNO3 – H2O | 3, 0 | |||||||
| C6H5CH3 – изо-C4H9OH | 1, 5 | |||||||
| HF – H2O | 2, 5 | |||||||
| C2H5OH – C2HCl3 | 2, 0 | |||||||
| HCOOH – H2O, p = 5, 33кПа | 1, 2 | |||||||
| H2O – HCOOH | 1, 6 | 106, 5 | ||||||
| C3H7OH – H2O | 2, 5 | |||||||
| C2H5OH – H2O | 2, 0 | |||||||
| изо-С3H7OH – H2O | 2, 0 | |||||||

Рисунок 2. 8 – Диаграмма состояния температура кипения – состав системы
|
|
|


Рисунок 2. 9 – Диаграмма состояния температура кипения – состав системы



Рисунок 2. 10 – Диаграмма состояния температура кипения – состав системы
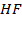
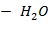

Рисунок 2. 11 – Диаграмма состояния температура кипения – состав системы
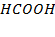
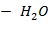 при давлении 5, 33 кПа
при давлении 5, 33 кПа
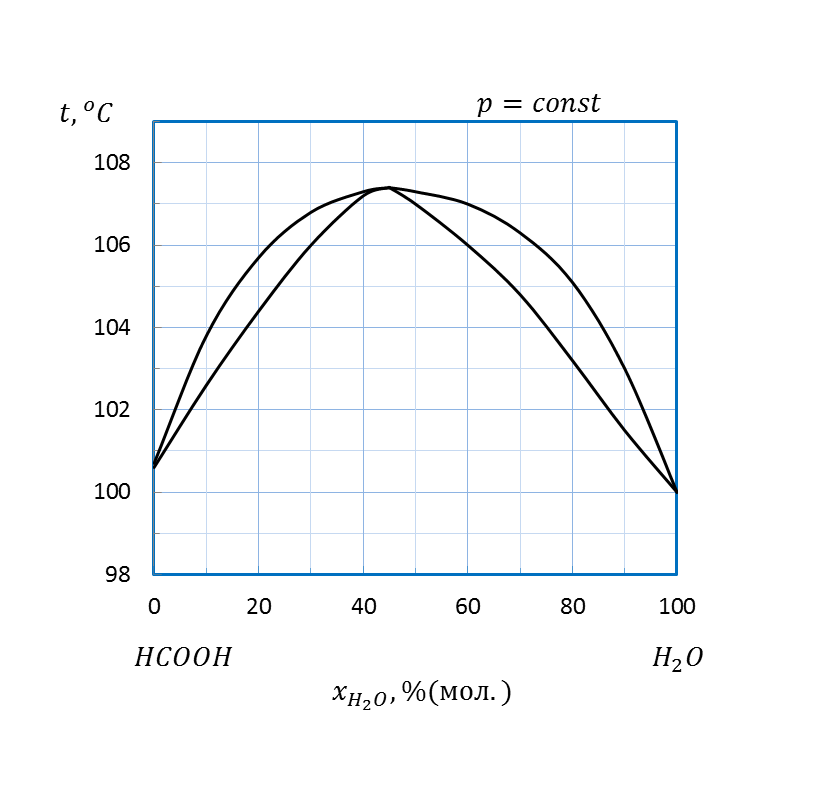
Рисунок 2. 12 – Диаграмма состояния температура кипения – состав системы



Рисунок 2. 13 – Диаграмма состояния температура кипения – состав системы

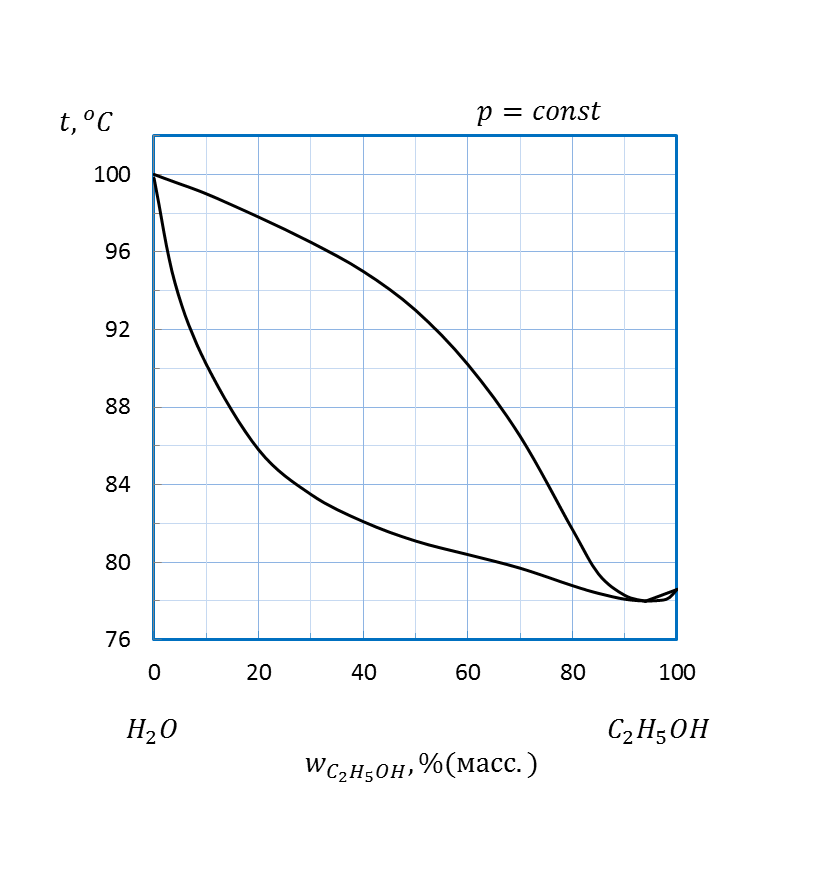
Рисунок 2. 14 – Диаграмма состояния температура кипения – состав системы
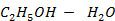

Рисунок 2. 15 – Диаграмма состояния температура кипения – состав системы
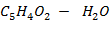 (фурфурол - вода)
(фурфурол - вода)

Рисунок 2. 16 – Диаграмма состояния температура кипения – состав системы
 (этиловый эфир - четыреххлористый углерод)
(этиловый эфир - четыреххлористый углерод)

Рисунок 2. 17 – Диаграмма состояния температура кипения – состав системы
изо - 
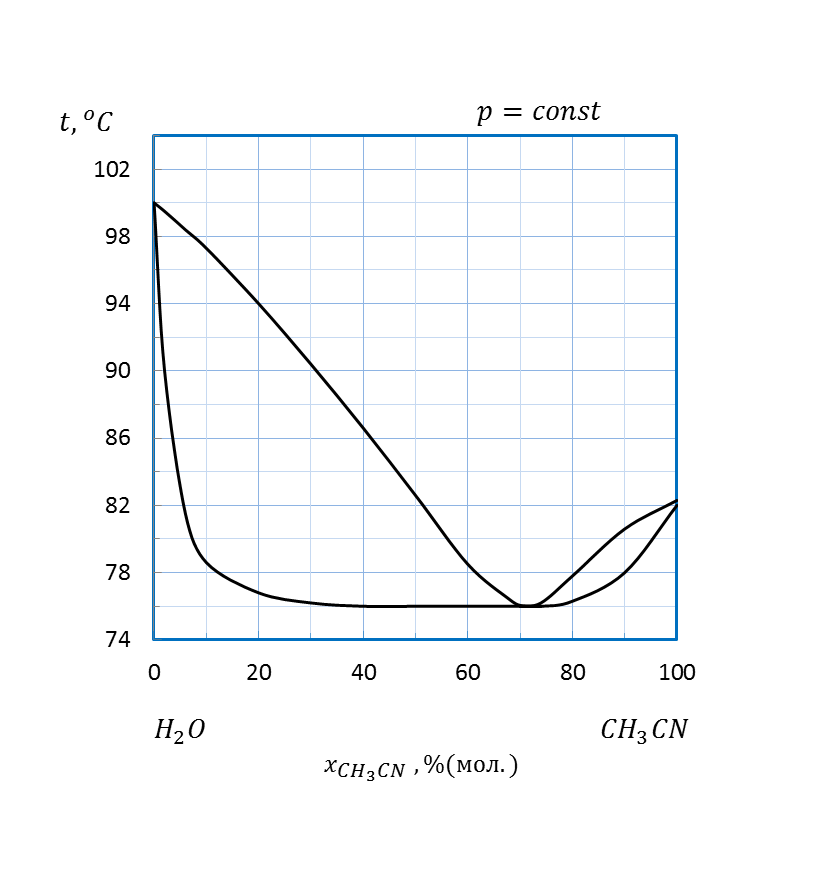
Рисунок 2. 18 – Диаграмма состояния температура кипения – состав системы


Рисунок 2. 19 – Диаграмма состояния температура кипения – состав системы
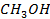

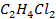

Рисунок 2. 20 – Диаграмма состояния температура кипения – состав системы
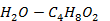 (1, 4-диоксан - вода)
(1, 4-диоксан - вода)

Рисунок 2. 21 – Диаграмма состояния температура кипения – состав системы


Рисунок 2. 22 – Диаграмма состояния температура кипения – состав системы
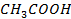

2. 2. 3 Диаграммы плавкости
2. 2. 3. 1 Типы диаграмм плавкости. Основные понятия
Графические зависимости, отражающие характер изменения температуры системы во времени, называются кривыми охлаждения.
Фигуративная точка – любая точка на диаграмме, характеризующая состояние системы.
Нода (или коннода ) – линия, соединяющая на диаграмме составы сопряженных фаз, находящихся в равновесии. Условиями равновесия являются равенство температур, давлений и химических потенциалов сосуществующих фаз.
Линия ликвидуса показывает зависимость температуры начала кристаллизации (или температуры конца плавления) от состава жидкой фазы или зависимость растворимости компонентов от температуры.
Линия солидуса описывает зависимость температуры конца кристаллизации (или температуры начала плавления) от состава твердой фазы.
Эвтектическая точка соответствует трехфазному равновесию, когда из расплава одновременно кристаллизуются две твердые фазы.
|
|
|
Перитектическая точка ( перитектика ) проявляется часто в виде перегиба на кривой ликвидуса, также соответствует равновесию трех фаз в случае, когда одна твердая фаза исчезает, а другая, наоборот, появляется (т. е. имеет место перекристаллизация).
Основные типы простейших диаграмм плавкости двухкомпонентных систем приведены на рисунке 2. 23.
Диаграммы плавкости реальных систем, представленных ниже, взяты из базы данных ACerS-NIST Phase Equilibria Diagrams, Version 3. 1 [10].


| а б в |
| a б в |
| г д е |
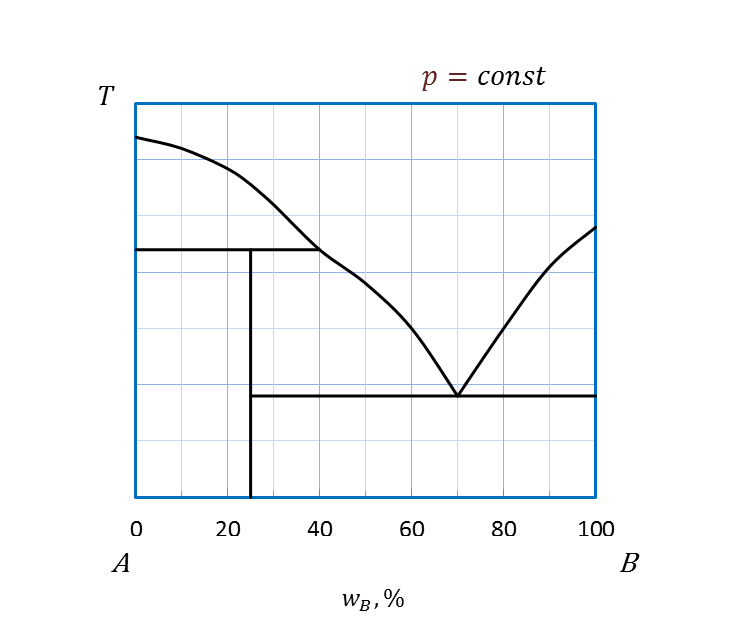


Рисунок 2. 23 - Диаграммы плавкости системы, компоненты которой:
а – полностью не растворимы друг в друге и в жидком и в твердом состояниях;
б – неограниченно растворимы друг в друге в жидком и в твердом состояниях;
в – неограниченно растворимы в жидком и полностью не растворимы
друг в друге в твердом состояниях;
г - неограниченно растворимы друг в друге в жидком и ограниченно в твердом состоянии;
д – неограниченно растворимы в жидком, полностью не растворимы
друг в друге в твердом состояниях и
образуют между собой в твердом состоянии
химическое соединение, плавящееся без разложения;
е - неограниченно растворимы в жидком, полностью не растворимы
друг в друге в твердом состояниях и
образуют между собой в твердом состоянии
химическое соединение, плавящееся с разложением
Ниже представлено описание фазового состава характерных областей простейших диаграмм состояния.
|
|
|


