 |
Механизмы инактивации тромбина серпинами.
|
|
|
|
Глава 3. Механизмы регуляции гемостаза
Регуляция гемостаза осуществляется на нескольких уровнях:
1) первичный гемостаз- механизмы дезагрегации (ПГ12, NO) и ингибиторы агрегации (АДФ аза(CD39)), блокирование рецепторов адгезивных белков);
2) вторичный гемостаз: инактивация тромбина (серпины), связывание тромбина(тромбомодулин(ТМ)), блокирование образования тромбина (система протеина С), ингибирование протеиназ системы свертывания, предшествующих появлению тромбина, в первую очередь, активных форм факторовX (Xa) и VII(VIIa)(кунины-TFPI, и др.);
3) фибринолиз, лизис сгустка фибрина, ингибиторы фибринолиза.
Механизмы регуляции вторичного гемостаза объединяются понятием противосвертывающей системы. Теоретически при свертывании крови из протромбина, концентрация которого в циркуляции достаточно высока(0,1г/л), может образоваться 150ед тромбина на мл крови. Но практически образуется не более 10-15ед/мл поскольку в норме эффективно работают механизмы регуляции концентрации тромбина в кровотоке.
Небольшие (нM) концентрации тромбина, которые могут генерироваться в микрососудах при физиологических состояниях, связываются рецепторами эндотелия, в первую очередь - тромбомодулином, который занимает участок связывания тромбина с фибриногеном и рецепторами семейства PAR - ABE1(анион-связывающий экзосайт 1). Поэтому тромбомодулин блокирует свертывающую активность тромбина и его способность активировать тромбоциты и другие клетки. Более того в комплексе с тромбомодулином тромбин активирует систему протеина С. Активированный протеин С ингибирует дальнейшее образование тромбина, блокируя кофакторы свертывания - факторы Vа и VIIIа, и активирует фибринолиз, освобождая тканевой активатор плазминогена, который превращает плазминоген в плазмин, лизирующий фибрин.
|
|
|
При появлении тромбина в концентрациях выше нМ работает следующий уровень регуляции–инактивация его антитромбином III, связанным с гликозаминогликанами эндотелия. Свободныйантитромбин – не эффективный ингибитор/субстрат тромбина, поскольку имеет конформацию молекулы не комплементарную связывающим участкам молекулы тромбина. Изменение конформации антитромбина в форму, эффективно взаимодействующую с тромбином, происходит при связывании с гликозаминогликанами (ГАГ) эндотелия, например, с гепаран сульфатом или с хондоитин сульфатной цепью молекулы тромбомодулина, или гепарином, освобождаемым тучными клетками, или введенным внутривенно.
Механизмы инактивации тромбина серпинами.
Ингибиторы сериновых протеиназ: антитромбин III (АТIII), a 1-ингибитор протеиназ(a 1-ИП,син. a1 -антитрипсин), кофактор II гепарина и ингибитор ФXa, зависимый от протеинаZ (ZPI) называют серпинами (Таблица).
Серпины происходят от общего предшественника. Их функции дивергировали в эволюции, которая происходила параллельно эволюции сериновых протеиназ, прошедших путь от трипсиноподобных протеиназ широкого спектра протеолиза до высокоспецифичных, регуляторных протеиназ, способных быстро и точно реагировать на нарушение гемостаза.
Несмотря на высокую степень гомологии аминокислотной последовательности АТIII и a1 -ИП, их специфичность различна. Это обусловлено существованием в реактивном участке АТIII связи Арг393-Сер394,расщепляемой преимущественно тромбином и фактором Xa, тогда как в реактивном участке a1-ИП находится пептидная связь Мет358-Сер359, гидролизуемая эластазой нейтрофилов. Замена реактивного метионина в положении Р1 расщепляемой связи (по номенклатуре Шехтера и Бергера) на аргинин в мутантной молекуле a1 -ИП Питтсбург (названной по имени города, в котором обнаружен больной с этим дефектом) привела к изменению специфичности от протеазы химотрипсинового типа, как эластаза, к трипсиноподобным протеазам, таким как тромбин. Результатом гетерозиготного повреждения была смерть мальчика в очень молодом возрасте вследствие массивных и продолжительных кровотечений, поскольку дефектный a1-ИП, содержащийся в плазме в высокой концентрации (1,3г/л), имел свойства АТIII (0,15 г/л) - ингибитора тромбина, и блокировал даже низкие концентрации свертывающего фибриноген фермента.
|
|
|
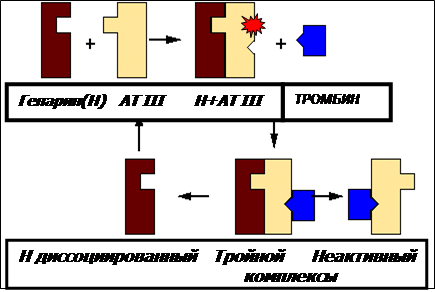
АТIII ингибирует протеиназы системы свертывания крови (преимущественно тромбин и факторXa) путем образования эквимолярного комплекса. Механизм инактивации подобен мышеловке (suicidesubstrate механизм), где ловушка (серпин) привлекает мышей (протеазы) куском сыра (реактивная петля ингибитора(субстрата)-RCL).
Изучение кристаллографических структур комплексов серпин-протеиназа позволило представить последовательность событий, ведущих к инактивации протеиназы Первый этап- узнавание активным центром протеиназы, а затем и связывание петли реактивного центра (RCL) серпина (АТIII). На следующем этапе происходит расщепление петли серпина протеиназой, быстрое включение петли RCL в середину складчатой структуры молекулы АТIII (b-sheet) и конформационные изменения серпина в более стабильное состояние.
Далее протеиназа, привязанная к петле реактивного центра серпина, передвигается к противоположному концу молекулы ингибитора, теряет упорядоченную структуру и активность. Таким образом, конформационные сдвиги в молекуле серпина напоминают работу мышеловки, которая физически захлопывает протеиназу. Изменение от стрессированной формы (метастабильной) серпина в релаксированное состояние сопровождается переходом в гиперстабильную форму молекулы, неактивную латентную форму. При этом происходит необратимое ингибирование протеиназы.
Реакция инактивации протеазы происходит медленно, но прогрессивно ускоряется гликозаминогликанами (ГАГ) эндотелия и гепарином. Поэтому АТIII носит название прогрессивного ингибитора.
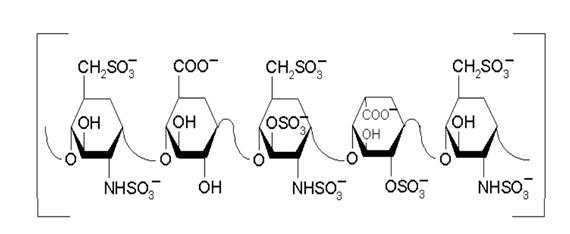
Гепарин- гликозаминогликан (ГАГ) с мол.массой 5-20кДа, синтезируется в тучных клетках, часто локализованных вдоль сосудов, как сополимер гексозамина и глюкуроновой кислоты. На последней стадии синтеза остатки глюкозамина деацетилируются и N-сульфатируются, а остатки глюкуроновой кислоты эпимеризуются в стериоизомер-идуроновую кислоту, имеющую ассимметричный атом углерода. Кроме того, идуроновая кислота сульфатируется (Рис).
|
|
|
Гепарин катализирует инактивацию протеиназ, повышая скорость реакции более чем в 1000раз. Драматическое повышение скорости ингибирования тромбина АТIII в присутствии каталитических количеств гепарина обусловлено связыванием этого полианиона с определенными остатками лизина (Лиз 114,Лиз125,Лиз287), а также Арг 47,Про41,Трп49 N (амино)-конца АТIII, формирующего гепаринсвязывающий домен(РИС).
 | |||
|
Молекулярной основой высокого сродства связывания гепарина с АТIII служит уникальный пентасахарид с 3-О-сульфатированным гликозамином в третьем остатке, который вызывает конформационную перестройку молекулы ингибитора, изменение в положении реактивного аргинина АТIII, благоприятствующее взаимодействию с тромбином и фактором Xa. Около 1/3 молекул гепарина содержат эту структуру и с высоким сродством связывают АТIII.
Изолированный пентасахарид малоэффективен в катализе ингибирования свертывания. Для связывания АТIII и протеиназы требуется фрагмент гепарина из 18 моносахаридов. Это так называемый низкомолекулярный гепарин (LMWH), который ингибирует преимущественно фактор Xa свертывания крови и тем самым останавливает процесс образования тромбина. При этом, чем короче цепочки молекулы гепарина, тем меньше ее способность образовывать комплексы, инактивирующие тромбин, и выше способность к избирательному блокированию только фактора Xa. Поэтому гепарины с низкой молекулярной массой (НМГ)ингибируют преимущественно фактор Xа, не вызывая при этом существенной нейтрализации тромбина. Один из них Надропарин кальция (Фраксипарин) (Mол вес 4,3 кДа), у которого соотношение анти-Xa и антитромбиновой активности составляет 3,3:1 (1), в то время как у гепарина - 1:1. Это позволяет добиться избирательного торможения свертывания на более ранней стадии процесса.
|
|
|
Надропарин кальция получают с помощью контролируемой деполимеризации гепарина натрия из слизистой оболочки тонкой кишки свиней и последующей хроматографической очисткой. Он состоит из сульфатированных олигосахаридов, содержащих остатки 2,5-ангидро-D-маннитола в качестве концевых групп.
Гепарин не фракционированный (НФГ) долгое время оставался золотым стандартом среди лекарственных средств с доказанной эффективностью в предупреждении и лечении как венозных, так и артериальных тромбозов и эмболий, в частности при лечении острого коронарного синдрома.
Однако целый ряд ограничений и побочных эффектов, свойственных этому препарату и, в первую очередь, короткий период полувыведения и необходимость постоянной внутривенной инфузии с лабораторным контролем, низкая биодоступность, относительно высокая частота геморрагических осложнений, зависимость эффекта от уровня АТIII плазмы, синдром "рикошета" при отмене, аллергенность и вызываемая им тромбоцитопения способствовали появлению нового класса антикоагулянтов с меньшей молекулярной массой.
Применение НМГ имеет ряд преимуществ перед НФГ: высокая антитромботическая активность при меньшем риске развития кровотечений; высокая биодоступность и предсказуемость действия; отсутствие необходимости частого лабораторного контроля; относительно пролонгированное действие; менее выраженное влияние на функцию тромбоцитов и повышение высвобождения ингибитора пути тканевого фактора эндотелием сосудов.
В настоящее время НМГ применяют при лечении тромбоза глубоких вен, тромбоэмболии легочной артерии(ТЭЛА), острого коронарного синдрома, нестабильной стенокардии, инфаркта миокарда и для профилактики тромбообразования у больных при операциях, а также для профилактики тромбоза в системе экстракорпорального кровообращения при гемодиализе и гемофильтрации.
Итак, при связывании АТIII с гепарином изменяется конформация АТ, повышается сродство к протеиназам. Существование в структуре АТIII двух участков связывания- реактивного, ответственного за связывание фермента, и домена,связывающего гепарин, подтверждено анализом заболеваний, вызванных врожденными дефектами молекулы АТIII. Замена Арг393 реактивного участка АТ III на Цис в АТ Норсвик Парк или на Гис в АТ Глазго блокировала способность ингибитора взаимодействовать с тромбином, что проявлялось в семейных тромбозах. Нарушения структуры домена, связывающего гепарин,вследствие замены Арг47 на Цис в АТ Тойома или на Гис в АТ Руан-1 также приводили к рецидивирующим тромбозам. Кроме того, с серьезными эпизодами тромбоза связаны конформационная нестабильность (аномалии) в молекуле АТIII, когда реактивная петля ингибитора в интактной (нерасщепленной форме) включается в складчатую структуру молекулы (как это происходит при физиологической реакции включения расщепленной петли при связывании антитромбина с протеиназой). Конформационная стабильность АТ возрастает при образовании комплекса с низкомолекулярным гепарином, что делает гепарин антикоагулянтом первого выбора при лечении конформационных тромбозов.
|
|
|
Гепарин содержится в гранулах тучных клеток и при активации клеток освобождается из гранул и может участвовать в регуляции гемостаза. Тучные клетки располагаются обычно вдоль сосудов. Доказательства секреции гепарина из тучных клеток при гиперкоагуляции были получены в опытах с радиомеченым гепарином. 35S-гепарин, введенный крысам, аккумулировался тучными клетками и освобождался ими в ответ на внутривенное введение тромбина. Освободившийся из тучных клеток меченый гепарин обнаруживали в основном на сосудистой стенке. При стрессорных ситуациях в активации секреции гепарина тучными клетками могут участвовать гормоны симпатоадреналовой системы и системы гипоталамус-гипофиз-кора надпочечников (адреналин,адренокортикотропный гормон(АКТГ)). Секреция гепарина тучными клетками происходит в ответ на высокие концентрации тромбина, а в низких концентрациях (nM) тромбин взаимодействует с тромбомодулином эндотелия и активирует систему протеина С, ограничивающую образование тромбина.
|
|
|


