 |
Глава 3 финансы в здравоохранении 40 глава
|
|
|
|
Теперь в соответствии с мировой практикой и приказом Минздрава РФ «О введении в действие отраслевого стандарта» (2001) каждый производитель отвечает за свою продукцию. При этом сроки проведения экспертизы ЛС (большую часть времени занимают клинические исследования) составляют несколько лет, что тоже соответствует мировой практике. Процедура проведения клинических испытаний требует соблюдения прав пациента, который должен быть застрахован в установленном законом порядке, а также иметь возможность выйти на любом этапе из процесса исследования.
Срок годности нормативной документации на все медицинские препараты (отечественные и зарубежные) составляет 5 лет. Перерегистрация является своеобразной гарантией того, что уровень качества производства
данного препарата становится, как правило, лучше, но никак не хуже. Переход фарм-предприятий на систему GMP потребовал больших финансовых инвестиций. Действуют также специальные санитарные правила и методические указания по системе слежения. В каждой упаковке препарата имеется вкладыш с адресом предприятия-изготовителя и адресом национального органа контроля. Кроме того, действует ряд нормативно-правовых документов, регулирующих систему клинических испытаний GMP, ICH.
Контроль выполнения утвержденных протоколов клинических испытаний лекарств осуществляют этические комитеты при медицинских учреждениях, а в лицензировании клинических баз активное участие принимает Минздрав России.

Рис. 76. Этапы проведения исследования фармацевтических препаратов
Сама процедура проведения клинических исследований состоит из нескольких этапов (рис. 76).
Требует совершенствования система контроля деятельности учреждений, разрабатывающих новые фармпрепараты и проводящих клинические исследования. Разрабатываются принципы независимого аудита и государственной инспекции клинических испытаний ЛС. В настоящее время государственным контролем охватываются аналогичные ЛС и БАД. Это многокомпонентные смеси, состоящие из 20-40 ингредиентов растительного и животного происхождения, лекарственных трав, экстрактов и порошков всевозможных природных (и не только таковых) продуктов. Многие из них плохо изучены на предмет эффективности и безопасности использования, имеют противопоказания к применению, которые не отражены в инструкциях по их применению. По этой причине Управление по контролю за качеством пищевых продуктов и лекарственных средств (FDA) США выпускает многочисленные предостережения и рекомендации пациентам по прекращению приема тех или иных разновидностей БАД.
|
|
|
Основные мероприятия при назначении фармакологической экспертизы заключаются в следующем:
• оценка качества и степени воздействия ЛС на организм больного;
• обоснование рекомендаций по применению медикаментозной схемы лечения пациентов с определенной нозологией с учетом ряда признаков (половозрастных, профессиональных, предрасположенности к аллергическим реакциям и др.);
• предупреждение возможного инициирования других (побочных) заболеваний. Те или иные осложнения фармакотерапии выявляются экспертами у 15-17% больных, а в 25% случаев фиксируется сомнительная целесообразность использования назначенных лекарств;
• изучение и повышение качества лечения;
• снижение его стоимости;
• внедрение экономичных способов повышения гарантий доступной и высококвалифицированной медицинской помощи;
• рационализация схем ресурсосберегающего потребления медикаментов. Подбор медикаментозного комплекса не всегда экономически правильный, особенно это касается такой сферы потребления ЛС, как стационарное лечение больных (так называемая полипрагмазия);
|
|
|
• стимулирование познания врачами фармакологии современных ЛС;
• усиление профессионального контроля использования ЛС и изделий медицинского назначения со стороны врачей, провизоров и фармацевтов;
• проведение независимой оценки качества фармацевтической продукции, предлагаемой на рынке;
• расширение перечня ассортимента фармацевтической и медицинской продукции, реализуемой через розничную сеть по единой лицензии организаций на фармацевтическую деятельность;
• ускорение создания нормативно-методической базы лекарственного обеспечения граждан применительно к рыночным условиям на основе международных стандартов;
• рациональность использования медикаментов;
• ограничение агрессивной рекламы дорогостоящих ЛС;
• защита прав застрахованных.
В России на федеральном уровне действует единая контрольно-разрешительная система в виде организационной структуры по контролю качества ЛС; на региональном уровне ее представляют юридически самостоятельные центры сертификации ЛС.
С целью обеспечения населения и лечебных учреждений безопасными, эффективными и доступными ЛС и изделиями медицинского назначения в Российской Федерации действует система государственного контроля в сфере обращения медицинской продукции (рис. 77).
Государственный контроль ЛС осуществляется в виде:
• предварительного государственного контроля ЛС (впервые производимых, впервые ввозимых на территорию РФ, выпускаемых по измененной технологии или после перерыва в производстве от 3 лет и более, в связи с ухудшением качества);
• выборочного государственного контроля ЛС (находящихся в обращении на территории РФ);
• повторного выборочного государственного контроля ЛС (в случае возникновения споров об их качестве между субъектами обращения ЛС);

Рис 77 Задачи структуры контроля качества медицинской продукции
• инспекционного контроля (организаций-производителей, предприятий оптовой торговли ЛС, аптечных учреждений и учреждений здравоохранения).
Сведения о регистрации содержатся в Государственном реестре ЛС, с которым можно ознакомиться в аптечных учреждениях.
|
|
|
Все ЛС, реализуемые населению, должны иметь документы, подтверждающие соответствие их качества установленным требованиям.
К таким документам относятся:
• подлинник сертификата, выданного до 01.04.07, или декларации о соответствии;
• копия сертификата, выданного до 01.04.07, заверенная держателем подлинника сертификата, нотариусом или органом, выдавшим сертификат;
• товарно-сопроводительные документы, оформленные изготовителем или поставщиком, содержащие по каждому наименованию ЛС номер сертификата соответствия (выданного до 01.04.07), указания на срок его действия, орган, выдавший сертификат или регистрационный номер декларации о соответствии, срок ее действия, наименование изготовителя (продавца), принявшего декларацию, и орган, ее зарегистрировавший (эти документы должны быть заверены подписью и печатью изготовителя/поставщика с указанием его адреса и телефона).
Важнейшей задачей системы фармаконадзора является мониторинг безопасности ЛС, уже обращающихся на рынке и широко применяемых в клинической практике. Его цель - выявление новых, не известных ранее нежелательных реакций и в случае их регистрации - своевременное внесение соответствующих изменений в действующие инструкции по медицинскому применению, а также информации об особенностях их развития, течения и лечения. Кроме того, задачами системы фармаконадзора являются распространение получаемых в ходе мониторинга данных через специализированные средства массовой информации, а также формирование и предоставление вниманию медицинской общественности объективной информации.
В последние десятилетия повышается частота нежелательных реакций ЛС. К причинам развития этой негативной тенденции можно отнести:
• широкое внедрение в клиническую практику новых препаратов с высокой биологической активностью;
• полипрагмазию и нерациональное использование ЛС;
• медицинские ошибки;
• распространение некачественных и фальсифицированных ЛС;
• растущую сенсибилизацию населения к биологически активным и химическим веществам;
|
|
|
• взаимодействия с другими ЛС и продуктами питания;
• фармакогенетические особенности пациентов;
• в ряде случаев терапевтическую неэффективность в реальных клинических условиях;
• ошибки в названиях ЛС.
В настоящее время фармаконадзор, призванный давать всестороннюю оценку безопасности ЛС, стал уже самостоятельной медицинской дисциплиной. Фармаконадзор представляет собой направление науки и практической деятельности, связанной с выявлением, оценкой и профилактикой неблагоприятных последствий или любой другой проблемой, имеющей отношение к медицине. Таким образом, это понятие включает в себя не только мониторинг безопасности лекарств, но и любых других средств, применяемых в медицине. При этом ключевой проблемой оптимизации работы системы фармаконадзора, остро стоящей во всем мире, являются недостаточные объемы информации о нежелательных реакциях ЛС, направляемой специалистами здравоохранения в соответствующие регуляторные органы.
ВОЗ укрепляет безопасность ЛС в рамках Международной программы мониторинга лекарств, которая начала действовать в 1968 г. Первоначально эта программа была пилотным проектом в 10 странах с установившейся национальной системой регистрации нежелательных реакций, но по мере того, как все большее число стран создавало национальные центры по контролю фармацевтической продукции для регистрации нежелательных реакций, эта сеть расширялась. В настоящее время в программе участвуют 86 стран.
Главной задачей Программы мониторинга лекарств является, насколько возможно более раннее обнаружение «сигналов» о проблемах в области безопасности лекарств. Такой сигнал определяется ВОЗ как «поступившая информация о возможной причинной связи между неблагоприятным событием и лекарством», которая не была выявлена ранее.
Информация о зарегистрированных случаях нежелательных реакций передается национальными центрами по контролю фармацевтической продукции в Сотрудничающий центр ВОЗ по международному мониторингу лекарств в Упсале (Швеция). Сообщения о таких случаях хранятся в базе данных нежелательных реакций ЛС. В ней насчитывается более 3,1 млн таких сообщений - это самый полный источник международной информации об осложнениях лекарственной терапии.
Кроме того, ВОЗ также:
• создала систему регулярного обмена информацией между государствами-членами о безопасности и эффективности фармацевтических препаратов с помощью сети специально назначенных национальных сотрудников по информации;
• обеспечивает оперативную передачу национальным органам здравоохранения новой информации о серьезных нежелательных реакциях на фармацевтические препараты;
|
|
|
• разрабатывает и распространяет руководящие принципы по созданию национальных центров мониторинга лекарств;
• проводит среди врачей и специалистов по мониторингу безопасности лекарств во всем мире подготовку в области применения новых и комплексных ЛС (например, антиретровирусных препаратов);
• проводит работу со странами по усилению органов, контролирующих лекарства, и созданию систем отчетности о нежелательных реакциях ЛС;
• способствует налаживанию контактов между основными участниками (регулятивными органами, полицией, таможенными службами и т.п.) для борьбы с фальсифицированными лекарствами на национальном, региональном и глобальном уровнях.
Будущее глобальной безопасности лекарств в значительной мере зависит от способности стран создать местные системы мониторинга лекарств, а также регистрации и хранения соответствующей информации. ВОЗ предполагает усилить свое техническое содействие национальным органам по контролю лекарств для достижения более полной согласованности в
области проведения мониторинга лекарств и реагирования на сигналы о неблагоприятных реакциях лекарств на национальном и глобальном уровне.
В России накоплен значительный опыт в области создания системы мониторинга безопасности ЛС. Так, еще в 1969 г. впервые был создан специальный Центр по изучению и регистрации побочного действия ЛС, который в 1973 г. был преобразован во Всесоюзный центр по изучению побочного действия ЛС. В 1997 г. открыт Федеральный центр по изучению нежелательных реакций ЛС, в составе которого была сформирована разветвленная сеть региональных центров. С 1999 г. и по сей день работа по мониторингу безопасности ЛС ведется сотрудниками Института доклинической и клинической экспертизы ЛС ФГУ «Научный центр экспертизы и средств медицинского применения». Региональные центры мониторинга безопасности ЛС продолжают активно функционировать на базах кафедр фармакологии вузов, ЛПУ, местных органов управления здравоохранением.
Источниками получения информации о безопасности ЛС выступают сами компании- производители, врачи, провизоры и фармацевты, а в ряде случаев - и потребители фармацевтической продукции. Однако на сегодняшний день основным способом сбора информации о нежелательных реакциях ЛС в большинстве стран мира является метод спонтанных сообщений - добровольного предоставления субъектами сферы обращения ЛС данных о наблюдаемых ими нежелательных реакциях лекарств. К преимуществам использования метода спонтанных сообщений можно отнести его простоту, экономическую доступность, возможность контролировать безопасность препарата в течение всего времени его пребывания на рынке, охват большого количества пациентов; а к недостаткам - невозможность выявить весь спектр нежелательных реакций ЛС и установить их истинную частоту. Тем не менее постоянно ведется работа по совершенствованию процедуры предоставления спонтанных сообщений, направленная на увеличение объема получаемых данных. Так, в Российской Федерации разработаны специальные инструкции и унифицированные информационные карты, создана и пополняется централизованная база данных.
Последствия нежелательных реакций ЛС нельзя недооценивать - зачастую они приводят к увеличению сроков стационарного лечения и последующей реабилитации, развитию осложнений, а в ряде случаев - и к летальному исходу. Во многих зарубежных исследованиях демонстрировалось, что прием лекарственных препаратов у 3-40% пациентов вызывал развитие лекарственных осложнений с серьезными (или фатальными) последствиями для здоровья. Было оценено, что в США смертность от нежелательных реакций лекарств занимает 4-6-е места. В исследованиях, проведенных в странах с отлаженной системой фармаконадзора, получены данные, согласно которым примерно 5% случаев госпитализации происходит вследствие нежелательных реакций лекарств, а 6-10% стационарных больных испытывают серьезные нежелательные реакции в период лечения в стационаре. Частота госпитализаций вследствие лекарственных осложнений достигает 11,5% в Норвегии, 13% - во Франции, 16% - в Великобритании. Однако эти цифры не отражают реального масштаба проблемы, поскольку в этих исследованиях исключены нежелательные события, вызванные другими, связанными с препаратом проблемами (например, передозировка, злоупотребление лекарственными травами, ненадлежащее и нерациональное применение лекарств, ошибки лечения и неэффективность лекарственной терапии).
В последние годы по распространенности нежелательных реакций стабильно лидируют антибактериальные препараты, НПВП и средства, влияющие на сердечно-сосудистую систему. Однако следует отметить, что данное явление связано в основном не с истинной токсичностью препаратов данных групп, а, скорее, с частотой их использования. Более чем в половине случаев причиной возникновения нежелательных реакций является полипрагмазия - назначение нескольких ЛС одновременно, зачастую без учета их взаимодействия.
Существенно повышает риск развития нежелательных реакций также нерациональное применение ЛС, в частности: недооценка анамнеза пациента, неправильный выбор ЛС и несоблюдение рекомендуемого режима их дозирования. Минимизировав указанные факторы, можно предупредить значительное количество лекарственных осложнений в реальной клинической практике, а это может быть достигнуто только путем информирования медицинской общественности об особенностях безопасности применения конкретных ЛС.
Системный и более эффективный характер приобретает организация государственного контроля качества, эффективности и безопасности медицинской техники, эксплуатируемой в организациях здравоохранения. Разработана и действует программа мониторинга медицинской техники, ее сертификации и испытания изделий.
Государственный контроль изделий медицинского назначения проводится:
• на этапе производства: плановые (периодические) и внеплановые проверки организаций - производителей изделий медицинского назначения;
• на этапе обращения.
Контроль поступления в лечебные организации качественной медицинской техники обеспечивается через нормативное регулирование Минздрава РФ. Регулируется нормативная база государственной регистрации изделий медицинского назначения через взаимодействие организаций - элементов системы контроля: Комитета по новой медицинской технике Минздрава РФ и базовых испытательных центров страны.
Испытание медицинской техники осуществляют более 130 учреждений здравоохранения, аккредитованных Минздравом РФ и уполномоченных на проведение клинических испытаний. Минздравом РФ ведется государственный реестр медицинской техники, в котором зарегистрировано около 2500 образцов отечественной медицинской техники и более 2 тыс. зарубежных образцов.
Важным направлением государственного контроля является организация метрологического обеспечения средств измерения медицинского назначения. Во исполнение Федерального закона «Об обеспечении единства измерений» при органах управления здравоохранением в 55 субъектах РФ действуют базовые организации метрологической службы. Создано 3 региональных организационно-методических центра Минздрава РФ по техническому обслуживанию и метрологическому обеспечению учреждений здравоохранения. Формируется единый порядок проведения государственного метрологического контроля и надзора за средствами измерения медицинского назначения.
Вопросы для повторения
1. Перечислите основные мероприятия по улучшению качества ЛС.
2. Назовите этапы и элементы проведения исследований фармацевтических препаратов.
3. В чем заключаются основные мероприятия к назначению фармакологической экспертизы?
4. Перечислите основные задачи государственного контроля в сфере обращения медицинской продукции.
5. Назовите виды государственного контроля ЛС.
6. Перечислите документы, подтверждающие качество ЛС.
7. Укажите цель мониторинга безопасности ЛС.
8. Назовите основные причины нежелательных реакций ЛС.
9. Назовите этапы государственного контроля изделий медицинского назначения.
10. Назовите основные элементы системы контроля безопасности медицинской техники.
ГЛАВА 9 ИНФОРМАЦИОННЫЕ ТЕХНОЛОГИИ В СИСТЕМЕ УПРАВЛЕНИЯ ЗДРАВООХРАНЕНИЕМ 9.1. ИНФОРМАЦИОННЫЕ РЕСУРСЫ ЗДРАВООХРАНЕНИЯ
Задача повышения структурной эффективности отрасли предполагает усиление требований к ресурсному обеспечению здравоохранения. Для выполнения возложенных на него функций ЛПУ современного типа обладает необходимыми ресурсами, перечень которых сегодня значительно расширился и включает как традиционные составляющие - основные фонды (здания и сооружения), медицинские приборы и оборудование, средства вычислительной техники и связи, финансовые и кадровые ресурсы, так и инновационные научные (интеллектуальные), информационные и технологические ресурсы (прогрессивные медицинские, организационные и управленческие технологии), ЛС, медицинский инструментарий, товары и изделия медицинского назначения и др.
Названные ресурсы определяют качество производства медицинских услуг, работы врачей- специалистов, а также эффективность управления ЛПУ. Именно «ресурсоемкость» ЛПУ обеспечивает качество предоставляемой населению медицинской помощи.
Только в последние 2 десятилетия с созданием в здравоохранении компьютерных информационных баз данных, массовым внедрением информационных систем появилось новое понятие - информационные ресурсы отрасли. Это самый ценный и динамичный вид медико-производственных ресурсов. Сегодня они в форме автоматизированных баз данных (БД) - медицинской, фармацевтической, экономической, финансовой и прочей информации, электронных аналогов медицинской документации (историй болезни, медицинских карт амбулаторных больных, карт вызова скорой медицинской помощи и др.), автоматизированных рабочих мест (АРМ) врачей и других медицинских работников, экспертных систем, электронных изданий медицинской научной и учебной литературы, телемедицинских и интернет-технологий предоставляют большие возможности информационного обеспечения профессиональной деятельности врача и овладения им современными достижениями медицины, основанной на доказательствах.
Информационные ресурсы и технологии оказывают кардинальное воздействие на трудовую деятельность специалистов и отвечают возросшим требованиям повышения доступности для широких слоев населения России высокоспециализированных видов медицинской помощи. В ряде регионов страны наработан богатый информационный потенциал здравоохранения. В настоящее время как никогда ранее необходимо сконцентрировать его на реализации повышения качества и доступности оказываемой населению медицинской помощи.
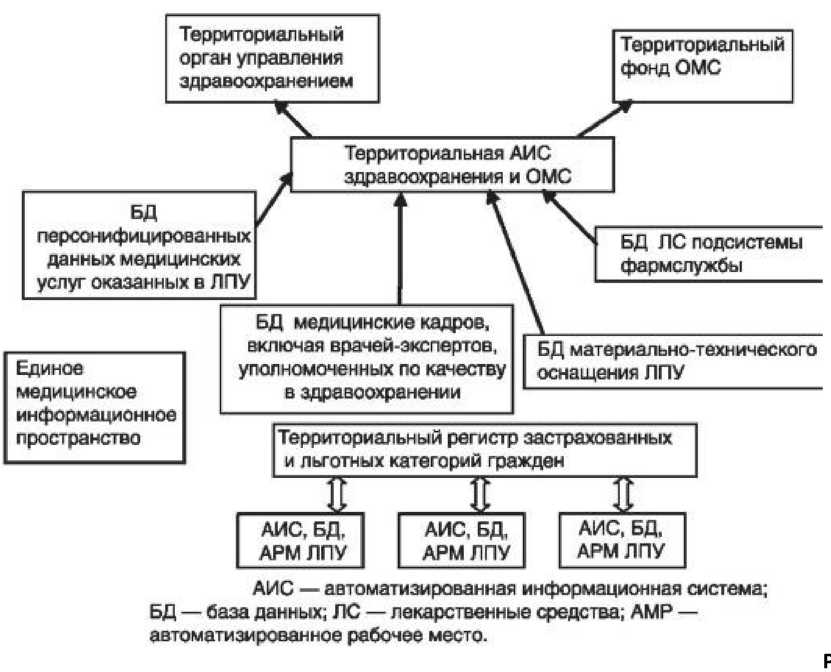
Рис.77 Информационные ресурсы территориального здравоохранения
Центральное место в медико-информационных структурах отводится БД, касающихся населения соответствующих территорий. К наиболее ценным информационным ресурсам территориального здравоохранения (рис. 78) относятся:
• БД застрахованного населения, фрагментом которых являются данные о льготных категориях граждан, для которых медицинское и медикаментозное обеспечение осуществляется с учетом назначенных им государственных льгот;
• базы персонифицированных медицинских данных о больных социально значимыми болезнями (регистры онкологических больных, больных туберкулезом, диабетом, ВИЧ-инфицированных и др.);
• медико-статистические базы персонифицированных данных медицинских услуг, включая услуги амбулаторно-поликлинической, стационарной, скорой и неотложной медицинской помощи, стоматологической помощи;
• базы финансово-экономической информации;
• БД по кадровому составу и материально-техническому оснащению ЛПУ;
• базы фармакоэкономических данных, регистры ЛС;
• базы нормативно-справочной информации и др.
В настоящее время в здравоохранении имеется большое количество разнообразных персонифицированных БД и регистров целевого назначения («Чернобыльский», «Сахарный диабет», БД специализированных медицинских служб, регистры поликлиник и т.д.) на всех уровнях - начиная с уровня учреждений до федерального включительно.

Рис 78 Структура автоматизированной БД ЛПУ
Одним из основных информационных ресурсов медицинского учреждения является его автоматизированная корпоративная БД (рис. 79), включающая сведения из медицинских карт пролеченных и находящихся на лечении больных, данные об объемах и характере оказанной им медицинской помощи, затратах медицинского учреждения на конкретного пациента, счетах на оплату этих услуг, финансовых потоках, формирующихся при оплате медицинской помощи, значительный объем нормативно-справочной медицинской и экономической информации.
Медико-статистический и финансово-экономический анализ деятельности отдельного медицинского учреждения и их территориальной сети, контроль качества оказываемой ими медицинской помощи базируется на информации этой БД.
Безусловно, важным вопросом является регламентирование порядка доступа к информационным ресурсам, порядка предоставления и защиты информации. Здесь прежде всего следует иметь в виду, что эти ресурсы имеют статус государственных информационных ресурсов. Они подразделяются на открытые (общедоступные) и на ресурсы ограниченного доступа (отнесенные к государственной тайне и конфиденциальные) в соответствии с законодательством Российской Федерации. К конфиденциальной информации относится информация о гражданах (персональные данные) и коммерческая информация. Порядок представления и права собственников документированной информации регламентируются ФЗ «Об информации, информатизации и защите информации» (1995) и другими федеральными законами.
Информационные ресурсы, являющиеся собственностью организаций, включаются в состав их имущества в соответствии с гражданским законодательством Российской Федерации (ст. 6 п. 5 указанного ФЗ РФ).
Накопленные за несколько лет достоверные данные территориального уровня по стационарной и поликлинической, санитарно-эпидемиологической службе позволяют выполнять прогнозирование, планирование и оценивать различные аспекты деятельности учреждений здравоохранения в целях управления. Однако эти БД имеют разные форматы и поддерживаются программами, выполненными на самом различном профессиональном уровне. Существующие в них подсистемы анализа данных, как правило, весьма ограничены и жестко регламентированы.
Поэтому необходима разработка (или адаптирование) универсальной системы анализа информации, которая могла бы настраиваться на структуру БД в любом формате и обеспечивала бы доступный пользовательский интерфейс для получения произвольной выборки и группировки информации с формированием заданных выходных документов. В этом случае можно существенно повысить эффективность использования персонифицированных баз данных и снизить затраты на их сопровождение. И сегодня можно с удовлетворением констатировать, что уже имеются варианты подобных пользовательских программных интерфейсов, использующих современную технологию клиент-сервер для интеграции, к примеру, всех источников информации по финансированию здравоохранения как по медицинскому страхованию, так и по бюджету. При этом периодичность запроса, обработки и анализа информации в них зависит только от пользователя.
Основу информационной инфраструктуры здравоохранения составляют медицинские информационно-аналитические центры - МИАЦ (содержание примерного Положения об организации деятельности МИАЦ раскрывается в информационном письме Минздрава РФ? 2510/9138-01-32 от 24.08.01 «О медицинском информационно-аналитическом центре») - правопреемники информационно-вычислительных центров и Бюро медицинской статистики органов управления здравоохранением субъектов Российской Федерации и координационные информационные центры СМО и департаментов здравоохранения муниципального уровня, на которые возлагаются функции сбора, контроля, обработки, экспертизы и анализа информации о процессах медицинского обслуживания населения соответствующих территорий.
Главная цель деятельности этих центров заключается в формировании на основе информационно-коммуникационных технологий (ИКТ) единой информационной системы здравоохранения Российской Федерации путем создания межотраслевой системы сбора, обработки, хранения и предоставления информации, обеспечивающей динамическую оценку состояния здоровья населения и информационную поддержку принятия решений, направленных на его улучшение. Предметом их деятельности является ведение интегрированных корпоративных БД и анализ медицинской статистической информации о сети, кадрах, деятельности организаций здравоохранения и состоянии здоровья населения, управление системой медицинского статистического учета и отчетности в организациях здравоохранения соответствующих территорий.
Однако одни только эти центры не в состоянии собрать воедино и «переварить» мощные потоки медицинской, медико-экономической, фармакологической, коммерческой, правовой и прочей информации, без которой невозможно разработать, обеспечить ресурсами и реализовать территориальную программу государственных гарантий бесплатной медицинской помощи гражданам, гармонизировать взаимоотношения между территориальными фондами ОМС, департаментами здравоохранения, СМО и ЛПУ.
При их непосредственном участии создается разветвленная многоуровневая система информационного обеспечения, выстраивается современная вертикаль управления здравоохранением.
В заключение отметим все возрастающую практическую роль международных медицинских информационных ресурсов, доступность к которым осуществляется средствами интернет- технологий. Так, ежегодно в мире появляется 2 млн медицинских статей, издается до 20 тыс. медицинских журналов. В этой ситуации с позиций компетентности остается один выход: обращаться к надежным информационным источникам, тщательно отфильтровывать и обобщать полученную информацию.
Для врачей-специалистов удобной с точки зрения поискового аппарата является информационная БД Medline, включающая около 75% мировых, преимущественно англоязычных изданий, и насчитывающая более 4 тыс. профессиональных и специализированных журналов. Medline содержит все ссылки, представленные в 3 ведущих медицинских библиографических справочниках: Index Medicus, Index to Dental Literature, International Nursing Index.
Если пользоваться базой Medline средствами Internet, оптимальным является выбор Medscape и Bio Med Net (www. bmn. com).
На основе Medline составлена база данных библиотеки Кохрейна (Cochrane library). Систематические обзоры - главная ее продукция; их объединяют результаты научных исследований с практическим использованием в здравоохранении.
Систематический обзор - это научное исследование с заранее спланированными методами, где объектом изучения служат не сами пациенты, а результаты ряда оригинальных исследований. Методология статистического объединения результатов надежных исследований носит название метаанализа. Систематические обзоры предназначены для того, чтобы найти ответы на определенные, часто довольно узкие, клинические вопросы.
|
|
|


