 |
Модели протекания апоптоза
|
|
|
|
Реферат
Роль митохондрий в апоптозе
Выполнила студентка 6 курса
лечебного факультета 2 группы
Цалко Екатерина Сергеевна
Гомель 2016
Содержание
| 1. | Введение | |
| 2. | Митохондрия как центральный контрольный пункт апоптоза | |
| 3. | Морфологические проявления апоптоза | |
| 4. | Модели протекания апоптоза | |
| 5. | Пять моделей высвобождения цитохрома С из митохондрии в процессе апоптоза | |
| 6. | Митохондриальная пора | |
| 7. | Митохондрии и старение | |
| 8. | Заключение | |
| 9. | Список используемого материала |
Введение
Апоптоз (в переводе с греческого означает «опадание листьев») — форма гибели клеток в многоклеточном организме вследствие реализации программы, приводящей к поэтапному прекращению его жизнедеятельности. Впервые этот термин был введен J.F. Kerr и соавт. (1972) при проведении электронномикроскопических исследований клеток, хотя принципы апоптоза были описаны ранее C. Vogin в 1842 году, а затем анатомом W. Flemming в 1885 году.
При апоптозе в клетке наблюдаются характерные молекулярные проявления, приводящие к цитологическим изменениям, которые характеризуются уменьшением ее размера, сморщиванием цитоплазматической мембраны, переходом фосфатидилсерина из внутреннего монослоя цитоплазматической мембраны в наружный монослой, конденсацией и фрагментацией ядра (кариопикноз и кариорексис), фрагментацией ДНК хромосом. Затем вследствие распада ядра и цитоплазмы формируются апоптические мембраносвязанные тельца с внутриклеточным содержимым, которые в последующем подвергаются фагоцитозу.
Ученые, занимающиеся апоптозом, выяснили, что в этом процессе колоссальную роль играют митохондрии. Эти органоиды выделяют в цитозоль вещества, которые повышают вероятность клетки быть подвергнутой апоптозу.
|
|
|
На данный момент известно
- нарушение электронного транспорта→оксислительного фосфорилирования →выработка аденозинтрифосфата (АТФ);
- высвобождение цитохрома С и др. медиаторов апоптоза;
- нарушение окислительного потенциала и образование
пероксидов.
Митохондрия как центральный контрольный пункт апоптоза
Центральным пунктом апоптоза является митохондрия. Она играет большую роль в апоптозе, вызываемом различными раздражителями; объединяет сигналы клеточной смерти посредством белков семейства Bcl-2 (белков, в зависимости от ситуации стимулирующих или подавляющих апоптоз) и активирует выход цитохрома С (белка, переносящего электроны между белковыми комплексами во внутренней мембране митохондрии), в результате чего митохондриальная мембрана становится проницаемой. Механизмы, которые приводят к этой проницаемости, ещё не до конца изучены. Выделяясь из митохондрий, цитохром С включается в состав апоптосомы.
Апоптосома – это комплекс, состоящий из белковой молекул третичной структуры. Ее появление активирует каспазы (относящиеся к классу цистеиновых протеаз, расщепляющие белки по аспарагиновой кислоте; при активации приобретают способность расщеплять основные внутриклеточные элементы), запускающие каскад апоптозных реакций. В состав апоптосомы входят Apaf-1 (апоптозный протеазоактивирующий фактор 1), прокаспаза и цитохром С. Этот комплекс, в присутствии АТФ или дАТФ, активирует каспазу 9. Активированная каспаза 9, в свою очередь, активирует другие каспазы, задачей которых является разрушение клетки.
Центральными белками апоптоза, которые сохраняются на протяжении всей эволюции, являются Bcl-2, Apaf-1 и определенного рода каспазы.
Если цитохром С высвобождает каспазы, то Bcl-2, белок, регулирующий программируемую клеточную смерть во многих клеточных системах посредством контроля проницаемости митохондриальной мембраны, можно считать защитным механизмом, предотвращающим выделение цитохрома С, то есть, подавляющим клеточный апоптоз. Поддержка этой идеи была взята от системы внеклеточного апоптоза, изученной на яйцеклетках лягушек рода Xenopus. В таких системах митохондрия должна продуцировать цитохром С, высвобождаемый при активации каспаз. Добавление экзогенного Bcl-2 предотвращает высвобождение цитохрома С и активацию каспаз. Клак и другие ученые также показали, что Bcl-2 может непосредственно взаимодействовать с митохондрией для предотвращения высвобождения цитохрома С.
|
|
|
Важный эксперимент показал, что Bcl-2 может блокировать апоптоз даже в клетках с отсутствующей митохондриальной ДНК (которая тоже контролирует процесс выхода цитохрома С в цитозоль), но после этого клетки не в состоянии осуществлять процесс окислительного фосфорилирования.
Апоптоз может проходить разными путями, даже в том случае, если митохондриальный противоапоптозный белок Bcl-2 отсутствует. Например, AIF (апоптоз инициирующий фактор) может вызывать апоптоз посредством управления проницаемостью мембраны митохондрии; активировать эндонуклеазы, расщепляющие ламину, ДНК и цитоскелет клетки, и всё это независимо от наличия в митохондрии Bcl-2.
Морфологические проявления апоптоза
Целостность плазматической мембраны при апоптозе не нарушается, хотя происходит ее выпячивание и «пузырение» за счет изменений цитоскелета. При апоптозе цитоплазма клетки уплотняется, хроматин конденсируется, ядро подвергается сморщиванию и в дальнейшем распадается на отдельные везикулы. На заключительных стадиях апоптоза фрагментации подвергаются сами клетки с формированием, так называемых апоптозных телец – фрагментов хроматина, окруженных мембраной.
Наиболее частыми нарушениями являются уменьшение митохондрий в размерах и гиперплотность их матрицы, такие особенности часто называют «митохондриальный пикноз» (т.е., сморщивание). Правда, эксперименты, проведенные на симпатических нейронах, показали, что если апоптоз вызван фактором роста нервов (NFG), то потеря нейронов блокируется с помощью каспазных ингибиторов, то есть, что переход от нормальной структуры к конденсированной является обратимым процессом. Кроме того, сильно влияют на апоптоз клеточные распределения митохондрий; митохондрии, как правило, разбросаны по всей клетке. И при митохондриальной конденсации (пикнозе) и при перинуклеарной кластеризации во многих типах клеток можно наблюдать выделение проапоптического белка Bax, относящегося к семейству белков Bcl-2.
|
|
|
Модели протекания апоптоза
На поверхности каждой клетки имеются «смертельные рецепторы», способные улавливать апоптические сигналы. Многие сигналы смерти поступают на митохондрию посредством белков семейства Bcl-2, таких, как белки Bid и Bad. Эти белки работают специфически.
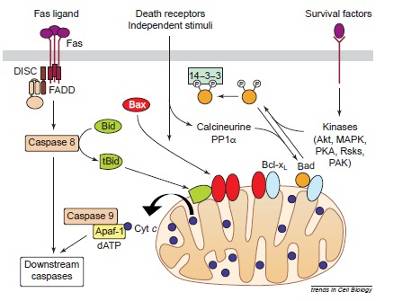
Рисунок 1.Различные механизмы апоптоза
1. В некоторых клетках белок Fas взаимодействует с трансмембранным белком, запуская тем самым программу смерти, что приводит к тримеризации Fas и формированию вызывающего клеточную смерть комплекса сигналов (DISC – death-inducing signaling complex). Этот комплекс так же называют апоптосомой, и он формируется путем объединения цитоплазматической области Fas, белка FADD и прокаспазы 8, способной к созданию активного фермента – каспазы 8.
Затем, каспаза 8 взаимодействует с белком Bid и расщепляет его до концевого продукта – t-Bid, который, активизирует Bax или Bax-подобные белки, способствующие активизации и выходу цитохрома С (смотри рисунок 5). Bax претерпевает морфологические изменения, олигомеризуется и встраивается во внешнюю мембрану митохондрии. Это способствует быстрому освобождению цитохрома с. Вполне возможно, что Bax вставляется в митохондрию прежде, чем олигомеризуется. Эти события могут быть вызваны посредством взаимодействия Bax с белком Bid или прокаспазой-8 вкупе с белками Bid и tBid, а так же, могут быть подавлены путем прямого взаимодействия Bax с белками Bcl-2 и Bcl-XL. Bax-подобный белок «Bak» активируется через аналогичные механизмы.
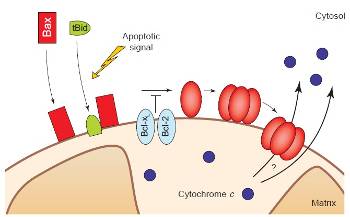
Рисунок 2. Высвобождение цитохрома С белком Bax
|
|
|
Есть, так же, вариант, когда t-Bid может активизировать цитохром С самостоятельно, без взаимодействия с Bax, встраиваясь в мембрану митохондрии и, вкупе с белком – порином, образуя канал проводимости.
После этого, в цитозоле, цитохром С активизирует каспазу 9, путем связывания Apaf-1 с АТФ/дАТФ и прокаспазой 9 (о комплексе которых уже говорилось ранее). После чего идет дальнейшее развитие апоптоза, сопровождающееся образованием новых каспаз и разрушением клетки.
2. Каспаза 8 может так же инициировать сигнальный путь, который не зависит от митохондрии, путем активизирования дальнейшего каскада реакций с образованием новых каспаз.
3. Белки Bad и Bax, перемещаясь по митохондрии, так же могут вызвать апоптоз, получив сигнал независимой от рецепторов смерти. В здоровых клетках Bad фосфорилируется в ответ на присутствие в клетке некоторых каспаз, таких как, Akt, митоген-активирующаяся протеиновая киназа (MAPC), Erk, PKA (протеинкиназа-А), Rsks (MAPK-активизирующаяся киназа) и PAK (p21-активизирующаяся киназа 1). Проще говоря, апоптоз не запускается в ответ на пролиферацию (разрастание) клеток.
Связывание Bad с сильными антиапоптозными белками Bcl-xL и Bcl-2, находящимися на мембране митохондрии, инактивирует последние, что ведет к клеточной гибели. Однако, будучи фосфорилированным, Bad может образовывать комплекс с 14-3-3 белком в цитоплазме, предотвращая тем самым связь Bad с митохондриально локализованными Bcl-xL и Bcl-2 и, таким образом, подавляя апоптоз. Два фосфорилированных сериновых остатка встраиваются в белковую последовательность 14-3-3. Фосфорилирование каждого остатка – как результат изоляции Bad в цитозоле.
4. При апоптозе Bad является дефосфорилированным и перемещается в митохондрии, где связывается с Bcl-xL. Между тем, Bcl-xL замещает Bad на Bax, тем самым подавляя апоптоз.
Если Bcl-2 включает механизм выживания клеток, то Bax ускоряет апоптоз. Bcl-2 и Bax могут образовывать гетеродимеры (причем, в данном случае, способности Bax заглушаются, и клетка выживает). Предполагается, что соотношение белков Bcl-2 и Bax может быть главной клеточной способностью к апоптозу.
Рисунок 3.Комбинации гетеродимеров, усиливающих и подавляющих апоптоз
Гетеродимер Bax + Bax способствуют клеточной смерти (рисунок слева) так же, как и комплекс Bcl-2 + Bcl-xs (рисунок справа).
Для активности, подавляющей смерть, Bcl-2 и Bcl-xL должны сформировать димеры с протеином Вах, в то время как димеры с протеином Bad усиливают смерть.
|
|
|


