 |
Выбор стандартного состояния
|
|
|
|
Понятие об активности компонента
Рассмотренные выше разбавленные и совершенные растворы относятся к классу идеальных растворов. Уравнения, выведенные для описания этих растворов, не пригодны для термодинамического анализа реальных металлургических систем: сплавов, шлаков, штейнов и др. Особенностью таковых является наличие в них взаимодействия между частицами компонентов раствора. Именно наличие этого взаимодействия обуславливает отклонения в поведении компонентов раствора от поведения компонентов в идеальных растворах. Термодинамические уравнения, выведенные для идеальных растворов, позволяют на основе свойств компонентов предсказывать свойства раствора в целом и наоборот. Поэтому возникла задача найти такую характеристику раствор, которая могла бы связать свойства реальных растворов, и на основании которой можно было хотя бы приближённо предсказывать свойства реального раствора на основе известных свойств компонентов. Из общих соображений эта характеристика должна отвечать следующим требованиям:
- через неё должны легко выражаться термодинамические свойства раствора;
- в предельных случаях, когда реальный раствор становится идеальным, она должна совпадать с концентрацией;
- с помощью этой характеристики желательно сохранить форму уравнений, выражающих законы идеальных растворов.
Всем этим требованиям отвечает термодинамическая активность. Под термодинамической активностью понимают величину, после подстановки которой в уравнения для идеальных растворов вместо концентрации компонента, становится возможным использовать эти уравнения для термодинамического анализа реальных растворов.
|
|
|
Одним из основных термодинамических уравнений теории растворов является уравнение химического потенциала. Это уравнение имеет вид:
- для растворённого вещества разбавленного раствора
μi = μ  + RTlnC1; (10.1)
+ RTlnC1; (10.1)
- для растворителя разбавленного раствора
μ1 = μ  + RTlnХ1; (10.2)
+ RTlnХ1; (10.2)
- для любого компонента совершенного раствора
μi = μ  + RTlnХ1. (10.3)
+ RTlnХ1. (10.3)
С учётом определения термодинамической активности уравнение химического потенциала компонента реального раствора будет иметь вид:
μi = μ  +RTln
+RTln  , (10.4)
, (10.4)
где μi – химический потенциал i – го компонента реального раствора;
μ  - стандартный потенциал i – го компонента реального раствора;
- стандартный потенциал i – го компонента реального раствора;
 -термодинамическая активность i –го компонента реального раствора.
-термодинамическая активность i –го компонента реального раствора.
Из уравнения (10.1) видно, что если  = 1, то μi = μ
= 1, то μi = μ  . Таким образом, в стандартном состоянии активность компонента реального раствора равна единице. Очевидно, что для компонентов идеальных растворов μ
. Таким образом, в стандартном состоянии активность компонента реального раствора равна единице. Очевидно, что для компонентов идеальных растворов μ  = μ
= μ  .
.
Термодинамическая активность является безразмерной величиной и определяется давлением насыщенного пара компонента. Рассмотрим равновесие раствор – пар. Для условий равновесия справедливо:
 μi = μi(газ) = μ
μi = μi(газ) = μ 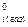 + RTlnPi (10.5)
+ RTlnPi (10.5)
C другой стороны для стандартного состояния, как и для любого, можно записать:
μ  = μ
= μ 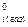 + RTlnP
+ RTlnP  (10.6)
(10.6)
Вычитая из уравнения (10.5) уравнение (10.6), получим:
μi = μ  + RTln
+ RTln  (10.7)
(10.7)
Сравнение (10.7) и (10.4) даёт:
 (10.8)
(10.8)
Таким образом, термодинамическая активность определяется как отношение давления пара компонента над реальным растворов к давлению пара этого компонента в стандартном состоянии.
Выбор стандартного состояния
Для расчёта активности компонента реального раствора помимо давления пара компонента над реальным раствором необходимо знать стандартное состояние этого компонента для определения давления его паров в этом состоянии. Обычно в качестве стандартного выбирается такое состояние компонента, при котором поведение реального раствора становится таким же, как и идеального. В таком состоянии активность компонента совпадает с его концентрацией.
|
|
|
Выберем стандартное состояние для компонентов реального раствора, близкого к совершенному раствору. Для любого компонента совершенного раствора справедлив закон Рауля:
Хi =  (10.9)
(10.9)
Для активности компонента реального раствора можно записать:
 =
=  (10.2)
(10.2)
Для стандартного состояния компонента реального раствора справедливо:
 или
или  =
=  (10.3)
(10.3)
откуда видно, что
P  = P
= P  (10.4)
(10.4)
Поскольку P  представляет собой давление пара компонента над чистым жидким компонентом, то в качестве стандартного состояния для любого компонента реального раствора близкого к совершенному раствору принимается чистый компонент. Тогда активность компонента такого раствора будет выражаться уравнением:
представляет собой давление пара компонента над чистым жидким компонентом, то в качестве стандартного состояния для любого компонента реального раствора близкого к совершенному раствору принимается чистый компонент. Тогда активность компонента такого раствора будет выражаться уравнением:
 , (10.5)
, (10.5)
а закон Рауля для каждого компонента раствора уравнением:
Pi =  iP
iP  , (10.6)
, (10.6)
где  - активность i – го компонента раствора;
- активность i – го компонента раствора;
Pi – давление пара i – го компонента над реальным раствором;
P  - давление пара i – го компонента над чистым жидким компонентом.
- давление пара i – го компонента над чистым жидким компонентом.
Рассуждая аналогичным образом, можно показать, что в качестве стандартного состояния для растворителя в реальном разбавленном растворе принимается чистый жидкий растворитель. Для него также справедливы уравнения (10.5) и (10.6).
Рассмотрим стандартное состояние для растворённого вещества реального разбавленного раствора. Для растворенного вещества идеального разбавленного раствора справедлив закон Генри:
Сi = ГiРi (10.7)
Активность растворённого вещества в разбавленном растворе определяется уравнением:
 =
=  (10.8)
(10.8)
Для стандартного состояния растворённого вещества реального разбавленного раствора справедливо:
 или ГiРi =
или ГiРi =  (10.9)
(10.9)
Из сравнения видно, что
Р  =
= 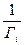 (10.10)
(10.10)
Уравнение (10.10) отвечает такому состоянию реального раствора при котором начинает соблюдаться закон Генри. Тогда закон Генри для растворенного вещества будет иметь вид:
 = ГiPi (10.11)
= ГiPi (10.11)
Количественной мерой отклонения в поведении компонентов реального раствора от поведения компонентов в идеальных растворах служит коэффициент активности компонента. Для растворителя в реальном разбавленном растворе и любого компонента реального раствора, близкого к совершенному раствору, коэффициент активности выражается уравнением:
|
|
|
γi =  , (10.12)
, (10.12)
а для растворённого вещества реального разбавленного раствора уравнением:
γi =  , (10.13)
, (10.13)
где γi – коэффициент активности i – го компонента раствора.
Если γi > 1, то говорят о положительном отклонении в поведении компонента от законов идеальных растворов. Если γi < 1, то говорят об отрицательном отклонении в поведении компонента от законов идеальных растворов. И если γi = 1, то имеет место идеальный раствор.

|
|
|


