 |
Аргентометрическое определение хлоридов в воде
|
|
|
|
Метод основан на титровании хлорид-ионов раствором нитрата серебра в нейтральной или слабощелочной среде (рН=6,5–10) в присутствии индикатора K2CrO4.
Сl- + Ag+ → AgCl ↓
Определению мешает присутствие ионов РО43 – (> 25 мг/л), Fe3+ (> 10 мг/л) и катионов, образующих осадки с Сl –.
Рабочий раствор нитрата серебра готовят следующим образом: AgNO3 – 2,4 г AgNO3 помещают в мерную колбу на 1 литр и доводят дистиллированной водой до метки. Точную концентрацию устанавливают по раствору NaCl, приготовленному из фиксанала или по точной навеске.
Раствор AgNO3 для качественного определения хлорид-ионов -10%-й.
Раствор K2CrO4 – 5%-й.
Выполнение определения
К 5 мл исследуемой воды добавляют 3 капли 10%-го раствора AgNO3. Приближенное содержание Сl – определяют в соответствии с таблицей
Таблица 1 – Характер осадка хлорида серебра в зависимости от концентрации хлорид-ионов
| Признаки | Опалесценция, слабая муть | Сильная муть | Хлопья, осаждающиеся не сразу | Белый объемистый осадок |
| Cодержание Сl – (мг/л) | 1–10 | 10–60 | 50–100 | > 100 |
В зависимости от содержания СГ необходимо брать для анализа различный объем воды. Если содержание хлорид-иона – в пределах 100–250 мг/л, для анализа необходимо брать 100 мл воды; если 250–280 мг/л – 50 мл воды; если > 800 мг/л – объем воды берется < 50 мл. Количественное определение С l –.
К необходимой для анализа аликвоте воды (100 мл или меньше) добавляют 1 мл 5%-го раствора K2CrO4 и титруют раствором AgNO3 до появления оранжево-бурой окраски. Расчет содержания хлоридов ведут по формуле:
 (.6)
(.6) 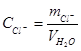 (.7)
(.7)
 (.8)
(.8)
где mCl− – масса хлорид-иона, г; CCl − концентрация хлорид-иона, мг/л; ТAgNO3/ Cl- – титр раствора AgNO3 пo хлорид-иону, г/мл; VAgNO3 – объем раствора AgNO3, израсходованный на титрование, мл; VH2O - объем воды, взятой для анализа, л.
|
|
|
Меркуриметрическое определение хлоридов
Метод основан на титровании хлорид-ионов раствором нитрата ртути (II) Hg(NO3) 2 в кислой среде в присутствии индикатора дифенилкарбазона.
2С1 +Hg2+ →HgCl
Метод позволяет определить от 1 до 10 мкг Сl - в пробе. Определению С l – мешает присутствие ионов S 2−, Br −, I -.
Рабочий раствор Hg(NO3)2 (0,1 н). Нитрат ртути (II) гигроскопичен, поэтому стандартный раствор его нельзя приготовить растворением точной навески. Обычно готовят вначале раствор Hg(NO3) 2 примерно 0,1 н. Для этого 16,7 г Hg(NO3) 2· 1/2H2О переносят в мерную колбу на 1 литр, добавляют 20 мл 6 н HNO3 (для улучшения растворимости Hg(NO3)2 и предупреждения ее гидролиза) и доводят дистиллированной водой до метки. Затем устанавливают его титр по раствору NaCl.
Раствор NaCl – 0,1 н (готовят из фиксанала или по точной навеске).
Дифенилкарбазон – 2%-й раствор.
Определение титра рабочего раствора Hg (NO 3)2.
К 10 мл 0,1 н раствора NaСl добавляют 1 мл 2%-го раствора дифенилкарбазона и титруют раствором Hg(NO3) 2 до появления синего окрашивания. Определяют титр раствора Hg(NO3)2

Выполнение определения
К 100 мл предназначенной для анализа воды (или к меньшему объему) добавляют 10 мл 2 н раствора HNO3, 1 мл 2%-ного раствора дифенилкарбазона и титруют раствором Hg(NO3)2 до появления сине-фиолетового окрашивания. По результатам титрования рассчитывают содержание хлоридов:
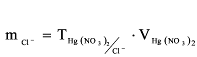
 (.)
(.)
где тС l – масса хлорид-иона, г; СCl – концентрация хлорид-иона, мг/л; ТHg(NO3)2 – титр раствора Hg(NO3)2 по хлорид-иону, г/мл; VHg(NO3)2 – объем раствора Hg(NO3)2, израсходованный на титрование, мл; VH2O – объем воды, взятый для анализа, л.
Выводы
Определения хлорид-ионов основаны на реакциях осаждения. Изменения концентрации и формы нахождения хлорид ионов вызывает изменение свойств системы, которые регистрируются как аналитический сигнал.
|
|
|
|
|
|


