 |
Теплоемкость газов. Первый закон термодинамики. Аналитическое выражение первого закона термодинамики. не исчезает и не возникает вновь, она лишь переходит из одной формы в другую, причем убыль энергии одного вида дает эквивалентное количество энергии друг
|
|
|
|
Теплоемкость газов
Отношение количества теплоты dQ, полученной телом при бесконечно малом изменении его состояния, к связанной с этим изменением температуре тела dT называется теплоемкостью тела [1]:
С=dQ/dT. (2. 5)
Коэффициент пропорциональности между количеством подведенной (отведенной) к телу теплоты и соответствующим изменением его температуры Т называется теплоемкостью Q=C T[3].

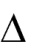
Обычно теплоемкость относят к единице количества вещества и в зави-симости от выбранной единицы различают:

удельную массовую теплоемкость с, отнесенную к1кг газа, Дж(кг К);
теплоемкость при постоянном давлении
| Ср=dqp / dT; | (2. 6) |
| теплоемкость при постоянном объеме | |
| С =dq / dT. | (2. 7) |
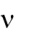
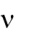
В курсе «Общей энергетики» мы коснемся науки термодинамики лишь в той части, чтобы сравнивать эффективность различных методов преобразования энергии. Простейшим критерием такого сравнения является коэффициент полезного действия (КПД) любого теплового двигателя, который определяется отношением полезно полученной работы к теплу, которое на получение этой работы затрачено.
| L | , | (2. 8) | |
| Q | |||
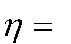
где L-полученная работа, Дж, Q1-теплота, затраченная на получение работы, Дж. Отнеся работу к 1 кг массы рабочего тела, получим удельную работу
| l | L | , | (2. 9) | |
| M | ||||
где М – масса рабочего тела, кг.
Величина l представляет собой удельную работу, совершаемую системой, содержащей 1 кг рабочего тела.
Аналогично определяется удельная теплота q1, Дж/кг,
|
|
|
| q1 | Q1 | (2. 10) | |
| M | |||
и представляет собой теплоту, затраченную на совершение работы системой, содержащей 1 кг рабочего тела.
Коэффициент полезного действия можно определить через удельные ве-личины теплоты и работы
Коэффициент полезного действия ТЭС, работающих на органическом топливе с паровыми турбинами, составляет около 40%, а КПД АЭС - около 30%, это объ-ясняется не столько недостатками имеющихся технологий, но и тем, что суще-ствуют объективные ограничения, связанные с законами термодинамики.
Первый закон термодинамики
Аналитическое выражение первого закона термодинамики
Первый закон термодинамики представляет собой частный случай все-общего закона сохранения и превращения энергии. Этот закон, полученный на основе обобщения огромного количества экспериментов, утверждает: энергия
не исчезает и не возникает вновь, она лишь переходит из одной формы в другую, причем убыль энергии одного вида дает эквивалентное количество энергии другого вида.
Пусть некоторому рабочему телу с объемом V и массой М, имеющему температуру Т и давление р, сообщается извне бесконечно малое количество теплоты dQ. В результате подвода теплоты тело нагревается на dT и увеличива-ется в объеме на dV.
Повышение температуры тела свидетельствует об увеличении кинетиче-ской энергии его частиц. Увеличение объема тела приводит к изменению по-тенциальной энергии частиц. В результате внутренняя энергия тела увеличива-ется на dU. Поскольку рабочее тело окружено средой, которая оказывает на не-го давление, то при расширении оно производит механическую работу dL про-тив сил внешнего давления. Так как никаких других изменений в системе не происходит, то по закону сохранения энергии
dQ = dU + dL, (2. 12)
|
|
|
т. е. теплота, сообщаемая системе, идет на приращение ее внутренней энергии и на совершение внешней работы.
Полученное уравнение является математическим выражением первого закона термодинамики. Каждый из трех членов этого соотношения может быть положительным, отрицательным либо равным нулю. Рассмотрим некоторые частные случаи.
1. dQ = O - теплообмен системы с окружающей средой отсутствует. Про-цесс без теплообмена называется адиабатным. Для него уравнение
| (2. 12) примет вид | |
| dL = - dU. | (2. 13) |
Следовательно, работа расширения, совершаемая системой в адиабатном процессе, равна уменьшению внутренней энергии данной системы. При адиа-батном сжатии рабочего тела затрачиваемая извне работа целиком идет на увеличение внутренней энергии системы.
2. dL = O - при этом объем тела не изменяется, dV = O ( изохорный процесс ). Уравнение принимает вид
| dQ = dU, | (2. 14) |
т. е. количество теплоты, подведенное к системе при постоянном объеме, равно увеличению внутренней энергии данной системы.
3. dU = O - внутренняя энергия системы не изменяется (изотермический процесс), и
| dQ = dL, | (2. 15) |
т. е. сообщаемая системе теплота превращается в эквивалентную ей внешнюю
| работу. | |||
| Для системы, содержащей 1 кг рабочего тела, | |||
| dq = du + dl. | (2. 16) | ||
| Проинтегрировав уравнения (2. 12) и (2. 16), получим выражение первого | |||
| закона термодинамики в интегральной форме: | |||
| Q= | U+L; | q= u + l, | (2. 17) |
| где | U=U2-U1, | u = u2 - u1. | |
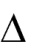

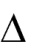
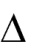
В циклическом процессе при возвращении рабочего тела в исходное со-стояние внутренняя энергия системы также приобретает исходное значение,
U=O, и, следовательно, выражение2. 17превращается в равенство
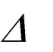
qц = lц,
где qц - представляет собой ту часть горячего источника, которая превращается
в работу цикла, lц. Это теплота, полезно использованная в цикле, она равна раз-ности q1-q2.
Вопросы для самопроверки
1. Дать определение тепловым двигателям, перечислить их.
2. Что такое удельная работа? Удельная теплота?
3. Дать определение термодинамическим параметрам: температура, давление; в чем они измеряются?
|
|
|
4. Что такое теплоемкость, какую теплоемкость различают?
5. Как определяется работа расширения? Чему она эквивалентна в р, v-диаграмме?
5. Сформулируйте первый закон термодинамики. Дайте его математическое выражение и рассмотрите частные случаи.
|
|
|


