 |
Неорганические растворители
|
|
|
|
Содержан
· 1 Твёрдые, жидкие, газообразные растворы
· 2 Истинные и коллоидные растворы
· 3 Растворение
· 4 Растворы электролитов и неэлектролитов
· 5 Растворы полимеров
· 6 Концентрация растворов
· 7 См. также
· 8 Примечания
· 9 Литература
Твёрдые, жидкие, газообразные растворы
Чаще под раствором подразумевается жидкое вещество, например раствор соли или спирта в воде (или даже раствор золота в ртути — амальгама).
Существуют также растворы газов в жидкостях, газов в газах и жидкостей в жидкостях, в последнем случае растворителем считается вода, или же компонент, которого больше.
В химической практике обычно под растворами понимают гомогенные системы, растворитель может быть жидким, твёрдым (твёрдый раствор), газообразным. Однако нередко допускается и микрогетерогенность — см. «Золи».
«Раствором» именуют и смесь цемента с водой, песком и так далее. Хотя это и не является раствором в химическом смысле этого слова.
Истинные и коллоидные растворы
Коллоидные и истинные растворы (изучением коллоидных систем занимается коллоидная химия) отличаются главным образом размерами частиц.
В истинных растворах размер частиц менее 1·10−9 м, частицы в таких растворах невозможно обнаружить оптическими методами; в то время как в коллоидных растворах размер частиц 1·10−9 м — 5·10−7 м, частицы в таких растворах можно обнаружить при помощи ультрамикроскопа (см. эффект Тиндаля).
Растворение
Растворение — переход молекул вещества из одной фазы в другую (раствор, растворенное состояние). Происходит в результате взаимодействия атомов (молекул) растворителя и растворённого вещества и сопровождается увеличением энтропии при растворении твёрдых веществ и её уменьшением при растворении газов. При растворении межфазная граница исчезает, при этом многие физические свойства раствора (например, плотность, вязкость, иногда — цвет, и другие) меняются.
|
|
|
В случае химического взаимодействия растворителя и растворённого вещества сильно меняются и химические свойства — например, при растворении газа хлороводорода в воде образуется жидкая соляная кислота.
Растворы электролитов и неэлектролитов
Электролиты — вещества, проводящие в расплавах или водных растворах электрический ток. В расплавах или водных растворах они диссоциируют на ионы. Неэлектролиты — вещества, водные растворы и расплавы которых не проводят электрический ток, так как их молекулы не диссоциируют на ионы. Электролиты при растворении в подходящих растворителях (вода, другие полярные растворители) диссоциируют на ионы. Сильное физико-химическое взаимодействие при растворении приводит к сильному изменению свойств раствора (химическая теория растворов).
Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами.
К электролитам относятся кислоты, основания и почти все соли, к неэлектролитам — большинство органических соединений, а также вещества, в молекулах которых имеются только ковалентные неполярные или малополярные связи.
Растворы полимеров
Растворы высокомолекулярных веществ ВМС — белков, углеводов и др. обладают одновременно многими свойствами истинных и коллоидных растворов.
Растворители - индивидуальное химическое соединение или их смесь, способная растворять различные вещества, то есть образовывать с ними однородные системы переменного состава двух или большего числа компонентов.
Практически любое вещество может быть растворителем для какого-либо другого вещества. Но на практике к растворителям относят только такие вещества, которые отвечают определённым требованиям:
|
|
|
· растворители должны обладать хорошей растворяющей способностью и быть достаточно химически инертными по отношению к растворяемому веществу и аппаратуре;
· растворители, применяемые в промышленности, должны быть доступными, дешёвыми и относительно безопасными.
В зависимости от отрасли промышленности к растворителям предъявляют и другие требования, которые обусловлены особенностями производства.
Существуют определённые принципы классификации растворителей.
· органический или неорганический
· жидкий и твёрдый
Существуют также количественные и полуколичественные классификации.
Органические растворители
Большое значение имеют многочисленные органические растворители, такие как:
· галогенопроизводные углеводородов;
· спирты;
· простые и сложные эфиры, кетоны, нитросоединения и др.
Органические растворители широко применяются в производстве пластмасс, лаков, красок, синтетических волокон, смол, клеев, применяются в полиграфии, в резиновой промышленности, при экстракции растительных жиров, для химической чистки одежды; кроме того, их используют для очистки химических соединений перекристаллизацией, при хроматографическом разделении веществ, для создания определённой среды и т. д.
Неорганические растворители
К числу неорганических растворителей относятся:
- вода (самый распространённый растворитель в природе);
- жидкий аммиак (хороший растворитель для щелочных металлов),
- жидкий сернистый ангидрит (растворитель для многих органических и неорганических соединений) и др.
Можно выделить группы растворителей в зависимости от других характеристик:
- температуры кипения - низкокипящие растворители (например, этиловый спирт, метилацетат) и высококипящие растворители (например, ксилол);
- относительной скорости испарения - быстроиспаряющиеся и медленноиспаряющиеся; полярности - неполярные и другие характеристики.
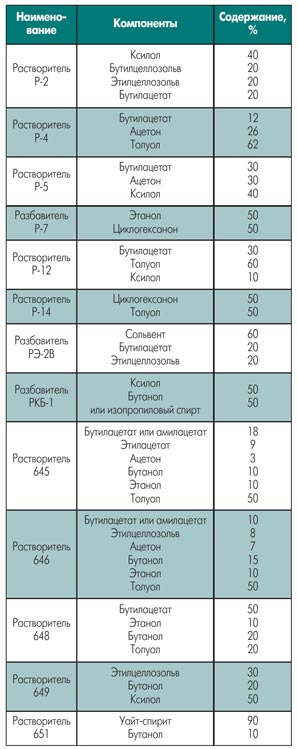
|
|
|


