 |
Методические указания к выполнению РГР №1
|
|
|
|
Введение
Количество знаний, получаемых студентами в вузе, во многом определяется соотношением лекционных и самостоятельных занятий. Сокращение объема обязательных аудиторных занятий связано с усилением роли самостоятельной работы студентов. Самостоятельная работа студентов при изучении курса «Общая энергетика» предусматривает выполнение следующих расчётно-графических работ (РГР):
1. РГР - 1. Расчёт термического КПД газового цикла.
2. РГР - 2. Термодинамические процессы с водяным паром.
Перед выполнением РГР необходимо самостоятельно проработать соответствующие разделы рекомендуемой литературы. При изучении каждого раздела желательно составлять конспект, особое внимание уделяя отчетливому представлению физической сущности вопроса.
Усвоение материала разделов можно проконтролировать по ответам на вопросы для самопроверки.
Расчётно-графические работы выполняются студентами на стандартных листах в соответствии с ЕСКД и защищаются в установленные графиком сроки после изучения соответствующих разделов теоретического курса.
Исходные данные для выполнения РГР необходимо выбрать из таблиц задания, в соответствии с вариантом и оформить на отдельном листе.
Содержание и последовательность выполнения РГР №1
Тема: «Расчёт термического КПД цикла газовой смеси»
Цель работы:
1. Практически закрепить знания основных законов термодинамики и идеальных газов.
2. Изучить методы расчёта параметров газовых смесей и использование их в рабочих циклах.
3. Получить практические навыки в определении в исследовании термодинамических процессов и определении термического КПД циклов смесей идеальных газов.
|
|
|
Последовательность выполнения работы:
1. Определить параметры Р, V, Т для основных точек цикла.
2. Полученные данные занести в таблицу 1.2.
3. На основании определенных параметров построить цикл в масштабе в
Р - V и Т - S диаграммах.
4. Определить значения теплоемкостей Срm и Сvm для каждого процесса.
5. Найти изменения внутренней энергии (∆u), энтальпии (∆h), энтропии
(∆S) в каждом процессе.
6. Определить теплоту (q) и работу (ℓ) в каждом процессе.
7. Результаты расчетов занести в таблицу 1.3.
8. Найти работу цикла и полезную теплоту.
9. Определить термический к.п.д. цикла.
Примечания:
1. Цикл отнесен к 1 кг газовой смеси, состав которой приведен в таблице 1.1.
2. Данные к расчетной работе составлены в форме циклов, изображенных в координатах Р - V, без учета масштаба и приведены на страницах 6, 7, 8, 9.
Задание к выполнению РГР №1






Рисунок 1.1 Термодинамические циклы идеальных газовых смесей
Методические указания к выполнению РГР №1
Для успешного выполнения РГР-1 необходимо изучить следующие разделы термодинамики [1]:
1. Параметры состояния.
2. Основные законы идеальных газов.
3. Смеси идеальных газов.
4. Теплоемкость.
5. I закон термодинамики.
6. II закон термодинамики.
7. Исследование термодинамических процессов.
Усвоение раздела можно проконтролировать по ответам на следующие вопросы:
1. Какие термодинамические параметры относятся к основным, их азмерности?
2. Понятие об идеальном газе.
3. Законы Бойля-Мариотта, Гей-Люссака и Шарля.
4. Адиабатный и политропный процессы, соотношения между основными параметрами в этих процессах.
5. Уравнение Клапейрона для произвольного количества газа.
6. Размерность газовой постоянной и ее физический смысл.
7. Физический смысл универсальной газовой постоянной, ее численное значение и размерность.
8. Что такое газовая смесь?
|
|
|
9. Способы задания состава газовой смеси.
10. Как рассчитываются молярная масса и удельная газовая постоянная смеси?
11. Как производится пересчет массового состава в объемный и из объемного в массовый?
12. Что называется удельной теплоемкостью, единицы измерения?
13. Как определить среднюю теплоемкость в интервале от t1 до t2?
14. Что такое изохорная и изобарная, истинная и средняя теплоемкости?
15. Напишите уравнение Майера и объясните смысл входящих в него величин.
16. Как рассчитывается массовая средняя теплоемкость газовой смеси?
17. Что понимается под внутренней энергией идеального газа и от каких параметров состояния она зависит?
18. Чему равно изменение внутренней энергии в круговом процессе?
19. Формулировки и аналитическое выражение I закона термодинамики.
20. Что называется круговым процессом (циклом)?
21. Основные формулировки II закона термодинамики.
22. Можно ли превратить в круговом процессе всю подведенную теплоту в работу?
23. Что называется термическим к.п.д. и как он определяется?
24. Что называется энтропией и каково изменение энтропии в цикле?
25. Что называется энтальпией и чему равно ее изменение в цикле?
26. Как определяется полезная работа в цикле?
27. Дать определение основным термодинамическим процессам, написать их уравнения.
28. Написать формулы работы изменения объема газа и теплоты для каждого процесса.
29. По каким уравнениям вычисляется изменение энтропии в каждом процессе?
30. Как определяются изменения внутренней энергии и энтальпии в любом термодинамическом процессе?
Порядок выполнения РГР №1
1. Расчет начинается с нахождения параметров первой точки, для которой известны 2 параметра, третий - находится по уравнению Клапейрона.
Для того чтобы использовать уравнение Клапейрона, необходимо знать удельную газовую постоянную смеси, которую можно рассчитать по формуле (1.32) [1] через кажущуюся молекулярную массу (см. §1.5) [1].
2. Затем рассчитываются недостающие параметры для точек 2,3,4,5. Для этого используйте соотношение между основными параметрами для каждого процесса (гл. 7) [1].
3. Найденные значения P,V,T заносятся в табл. 1.2. На основании этих данных строится цикл в масштабе в P-V и T-S диаграммах. Так как абсолютные значения энтропии (S) в точках не рассчитываются, то численное значение энтропии в точке 1 выбирается произвольно.
|
|
|
4. Находится массовая изобарная средняя теплоемкость смеси  по формуле:
по формуле:
 (1.1)
(1.1)
где mi - массовая доля i-го компонента газовой смеси;
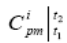 - изобарная массовая средняя теплоемкость i-го компонента в интервале температур от t1 до t2 ;
- изобарная массовая средняя теплоемкость i-го компонента в интервале температур от t1 до t2 ;
Если в варианте смесь задана объемными долями, то сначала производится пересчет на массовый состав (1.51) [1].
Изобарная массовая средняя теплоемкость i-го компонента в интервале температур от t1 до t2 находится отдельно для каждого газа по следующей формуле:
 (1.2)
(1.2)
где  - средние массовые изобарные теплоемкости в интервале температур, соответственно от 00 до t1 и от 00 до t2 находятся по таблице 1.4.
- средние массовые изобарные теплоемкости в интервале температур, соответственно от 00 до t1 и от 00 до t2 находятся по таблице 1.4.
Если в таблице нет вашего значения t1 или t2, то нужно произвести интерполяцию, т.е. нахождение промежуточных значений величины данной таблицы по некоторым известным значениям.
Например, найдем теплоемкость кислорода при температуре 170°C. Так как значения температуры 170°C в таблице нет, то выпишем ближайшие значения:

Теперь интерполируем между этими значениями:
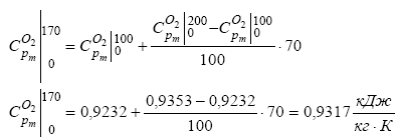
5. По уравнению Майера производится расчет массовой средней изохорной теплоемкости 

где Rсм – удельная газовая постоянная смеси, рассчитанная в п.1
6. Так как внутренняя энергия и энтальпия являются функциями состояния, то их изменения в любом термодинамическом процессе рассчитываются по формулам:
 (1.3)
(1.3)
 (1.4)
(1.4)
где  - соответственно, средние массовые изобарная и изохорная теплоемкости, кДж/кг∙К.
- соответственно, средние массовые изобарная и изохорная теплоемкости, кДж/кг∙К.
Т1, Т2 - температуры в начале и в конце процесса, К.
7. Изменение энтропии в зависимости от вида процесса рассчитывается по формулам (7.10; 7.21; 7.33; 7.34; 7.105) [1].
8. Работа изменения объема газовой смеси определяется для каждого процесса (см. §7.1-7.5) [1].
9. Количество подведенной или отведенной теплоты определяется по формулам (7.6; 7.17; 7.23; 7.76; 7.92; 7.94) [1].
10. Используя результаты расчетов, заполните табл. 1.3. По табл. 1.3 осуществляется проверка правильности произведенных расчетов. Если задание выполнено верно, то:
|
|
|
a) сумма изменений внутренней энергии в цикле должна равняться нулю:
∑ ∆ u = 0 (1.5)
b) сумма изменений энтальпий в цикле
∑ ∆ h = 0 (1.6)
c) сумма изменений энтропий в цикле
∑ ∆ S= 0 (1.7)
d) количество теплоты в процессе должно быть равно сумме изменений внутренней энергии и работы (I закон термодинамики):
q =∆u + ℓ, (1.8)
e) полезная теплота равна алгебраической сумме подведенной (q1) и отведенной (q2) теплот, а работа цикла равна алгебраической сумме работ всех процессов:
 qпол = q1 - q2 (1.9)
qпол = q1 - q2 (1.9)
ℓц = ∑ ℓi (1.10)
Так как во всех вариантах заданы прямые циклы, то полезная теплота и работа цикла должны иметь положительный знак и равняться друг другу.
11. Эффективность работы цикла определяется путем нахождения его термического к.п.д. (ηt) по формулам (3.12) или (3.13) [1].
Таблица 1.4 - Средняя массовая теплоемкость различных газов при Р=const,
 , кДж/кг.К
, кДж/кг.К

Содержание и последовательность выполнения РГР №2
Тема: «Расчёт термодинамических процессов с водяным паром»
Цель работы:
1. Практически закрепить знания основных законов термодинамики и идеальных газов.
2. Изучить методы расчёта параметров газовых смесей и использование их в рабочих циклах.
3. Получить практические навыки в определении в исследовании термодинамических процессов и определении термического КПД циклов смесей идеальных газов.
Пояснение к РГР №2:
Из точки 1, заданной двумя начальными параметрами, совершаются следующие процессы:
1-2 – изохорный (V1=V2)
1-3 – изобарный (P1=P3)
1-4 – изотермический (t1=t4)
1-5 – адиабатный (S1=S5)

Рисунок 2.1 Термодинамические диаграммы пароводяных смесей
Параметры в точках 1, 2, 3, 4 и 5 выбрать из табл.2.1 или табл.2.2 согласно заданному варианту по указанию преподавателя.
В качестве примера на рис.2.1 представлен один из вариантов происходящих процессов в рабочей диаграмме Р-V.
Последовательность выполнения РГР №2:
1. Определить для точек 1, 2, 3, 4 и 5 параметры Р, V, t, h, S, u, x, используя таблицы водяного пара.
2. Определить для каждого процесса изменение внутренней энергии (∆u), энтальпии (∆h), энтропии (∆S), произведенную работу (ℓ) и количество сообщенного или отведенного тепла (q).
3. Расчет адиабатного (или изотермического) процесса произвести также по h-S диаграмме водяного пара и определить относительную ошибку для каждой найденной величины по сравнению с табличными.
4. Изобразить процессы в масштабе в P-V, T-S, h-S диаграммах.
Параметры, найденные в табл.2.1 или табл.2.2, имеют следующие размерности Р- бар; t-оС; V- м3 /кг; h- кДж/кг; S- кДж/кг⋅К.
|
|
|


