 |
Буферные системы живого организма
|
|
|
|
Организм человека поддерживает постоянство внутренней среды – гомеостаз. Кислотно-основной гомеостаз означает постоянное значение рН биологических жидкостей: плазма крови – 7,4±0,05; эритроциты – 7,25; желудочный сок – 0,9¸1,1; поджелудочная железа – 7,5¸7,8. Постоянное значение рН необходимо для функционирования ферментов и гормонов, которые проявляют активность только в узком интервале рН (пепсин рН 1, амилаза рН 6,7, трипсин 7,5¸8), для поддержания осмотического гомеостаза, для обеспечения каталитического действия ионов Н+.
Особенно важно поддержание постоянства рН крови. Отклонение рН плазмы крови на 0,4 ед. может за собой летальный исход. Отклонение рН в кислотную область называют ацидозом, в щелочную – алкалозом.
Поддержание постоянного уровня рН в крови и тканевых жидкостях достигается с помощью регуляторных механизмов, включающих несколько буферных систем. Основными буферными системами крови являются следующие.
1. Гидрокарбонатная буферная система, характеризующаяся равновесием молекул слабой угольной кислоты с образующимися при ее диссоциации гидрокарбонат-ионами:
H2CO3 = H+ + HCO3-
В организме угольная кислота возникает в результате гидратации диокида углерода – продукта окисления углеводов, белков и жиров.
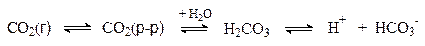
При ацидозе это равновесие смещается влево и избыток СО2 через легкие выводится из организма. Ацидоз может быть вызван, например, образованием в мышцах избытка молочной кислоты при интенсивной физической нагрузке.
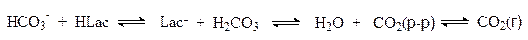
Ацидоз возникает также в душных помещениях при избытке в воздухе СО2.
рН гидрокарбонатного буфера определяется уравнением:
рН = pKa1(H2CO3) + lg 
Для поддержания нормального значения рН плазмы крови 7,4, соотношение  должно быть равно11,2. Так как концентрация гидрокарбонат-ионов в крови существенно выше, буферная емкость гидрокарбонатного буфера в крови по кислоте (40 ммоль/л) значительно больше, чем по щелочи (1-2ммоль/л).
должно быть равно11,2. Так как концентрация гидрокарбонат-ионов в крови существенно выше, буферная емкость гидрокарбонатного буфера в крови по кислоте (40 ммоль/л) значительно больше, чем по щелочи (1-2ммоль/л).
|
|
|
1. Фосфатная буферная система характеризуется равновесием между гидрофосфат- и дигидрофосфат-ионами:
H2PO4- = HPO42- + H+
и обусловлена присутствием в основном неорганических фосфатов.
Эта буферная система играет важную роль в поддержании постоянства рН крови, особенно внутриклеточной жидкости эритроцитов. рН фосфатного буфера рассчитывается по формуле:
рН = pKa2(H3PO4) + lg 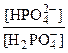
и соотношение 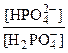 в плазме крови (рН 7,4) составляет 1,6.
в плазме крови (рН 7,4) составляет 1,6.
Буферная емкость фосфатной буферной системы ниже, чем гидрокарбонатной: по кислоте – 1-2 ммоль/л, по щелочи – 0,5 ммоль/л.
Белковые буферные системы.
Основными белками крови являются гемоглобин, оксигемоглобин, альбумин. Значение изоэлектрической точки этих белков лежит в интервале 4,9¸6,3, т.е. при физиологическом значении рН они представляют собой анионы, а их буферное действие обеспечивается существованием равновесия:
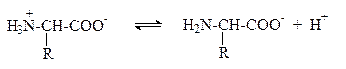
Это равновесие между ионами гемоглобина Hb- и самим гемоглобином HHb, являющимся очень слабой кислотой (KHHb = 6,3×10-9, pKHHb = 8,2), а также равновесие между ионами оксигемоглобина HbO2- и самим оксигемоглобином HhbO2, который является несколько более сильной кислотой, чем гемоглобин (KHHbO2 = 1,12×10-7, pKHHbO2 = 6,95).
В эритроцитах белковая система гемоглобин-оксигемоглобин тесно связана с гидрокарбонатной буферной системой.
Мощность буферных систем плазмы крови уменьшается в направлении:
гидрокарбонатная (40 ммоль/л) > белковая (3¸10 ммоль/л) > фосфатная (1¸2ммоль/л)
Гидролиз солей
Гидролиз солей – это взаимодействие солей с водой, которое приводит к образованию слабых электролитов.
Гидролиз протекает в том случае, если ионы, образующиеся при диссоциации соли способны вступать в кислотно-основное взаимодействие с водой с образованием слабой кислоты или слабого основания. При этом сдвигается равновесие электролитической диссоциации воды, что приводит к изменению рН раствора.
|
|
|
По характеру гидролиза соли делят на 4 типа.
1. Соль образована катионом сильного основания и анионом слабой кислоты (KCN, Na2CO3, Ca(CH3COO)2 и др.).
Такие соли гидролизуются по аниону, и реакция среды их растворов – щелочная, например:
KCN + H2O = HCN + KOH
CN-+ H2O = HCN + OH-
Если соль образована анионом слабой многоосновной кислоты, то гидролиз протекает по ступеням, например:
Na2CO3+ H2O = NaHCO3+ NaOH
CO + H2O = HCO3- + OH-
NaHCO3+ H2O = H2CO3+ NaOH
HCO + H2O = H2CO3+ OH-
2. Соль образована катионом слабого основания и анионом сильной кислоты (NH4Cl, CuSO4, Zn(NO3)2 и др.).
Такие соли гидролизуются по катиону, и реакция среды их растворов – кислая, например:
NH4Cl + H2O = NH4OH + HCl
NH + H2O = NH4OH + H+
Если соль образована катионом слабого многокислотного основания, то гидролиз протекает по ступеням, например:
ZnCl2+ H2O = ZnOHCl + HCl
Zn2++ H2O = ZnOH++ H+
ZnOHCl + H2O = Zn(OH)2+ HCl
ZnOH++ H2O = Zn(OH)2+ H+
3. Соль образована катионом слабой кислоты и анионом слабого основания (NH4CN, Fe2(CO3)3, Al2S3 и др.).
Такие соли гидролизуются и по катиону, и по аниону, и реакция среды их растворов близка к нейтральной, например:
NH4CN + H2O = NH4OH + HCN
NH + CN-+ H2O = NH4OH + HCN
4. Соль образована катионом сильного основания и анионом сильной кислоты (NaCl, K2SO4, Ba(NO3)2 и др.).
Такие соли не подвергаются гидролизу, так как ни катион, ни анион такой соли не образует при взаимодействии с водой слабых электролитов. Реакция среды растворов таких солей нейтральная.
Гидролиз большинства солей – это обратимый процесс, к которому применим закон действия масс. Например, для реакции гидролиза KCN
CN-+ H2O = HCN + OH-
можно записать константу равновесия:
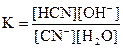 .
.
Концентрация молекул воды в разбавленных растворах практически постоянна, поэтому величина K [H2O] также постоянна и называется константой гидролиза Кг. Константа гидролиза зависит от природы соли и температуры и не зависит от концентрации соли.
Для рассматриваемой соли:
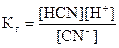 .
.
Умножим числитель и знаменатель правой части уравнения на [OH-]:
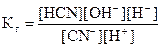
В полученном выражении
|
|
|
[H+][OH-] = Kw
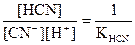 .
.
Таким образом
 .
.
В общем случае, константа гидролиза соли, образованной катионом сильного основания и анионом слабой кислоты равна отношению ионного произведения воды к константе кислотности слабой кислоты:

Аналогичные рассуждения для солей других типов приводят к следующим соотношениям.
Константа гидролиза соли, образованной катионом слабого основания и анионом сильной кислоты равна отношению ионного произведения воды к константе основности слабого основания:
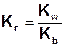
Константа гидролиза соли, образованной катионом слабого основания и анионом слабой кислоты равна отношению ионного произведения воды к произведению констант диссоциации слабой кислоты и слабого основания:

Анализ полученных уравнений показывает, что чем слабее кислота или основание, анион или катион которых входит в состав соли, тем больше значение константы гидролиза и тем полнее идет гидролиз.
При гидролизе соли по ступеням каждой ступени соответствует своя константа гидролиза. Как было показано выше, гидролиз Na2CO3 протекает в две ступени. Первая ступень гидролиза протекает по уравнению:
CO + H2O = HCO3- + OH-

Умножим числитель и знаменатель полученного выражения на [H+]:

или
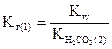 ,
,
где 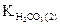 - константа кислотности угольной кислоты по второй ступени.
- константа кислотности угольной кислоты по второй ступени.
Гидролиз по второй ступени идет до образования угольной кислоты:
HCO + H2O = H2CO3+ OH-
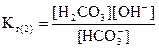
Умножим числитель и знаменатель полученного выражения на [H+]:

или
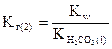 ,
,
где 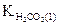 - константа диссоциации угольной кислоты по первой ступени.
- константа диссоциации угольной кислоты по первой ступени.
В общем случае, для соли, образованной анионом слабой многоосновной кислоты:
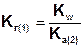
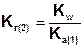
Так как Ka(1) > Ka(2), то Kг(1)>Kг(2). Поэтому в обычных условиях гидролиз по второй ступени практически не идет и при расчетах им можно пренебречь. Это касается и гидролиза солей образованных катионом слабого многокислотного основания и анионом сильной кислоты, для которых
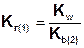
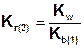 .
.
|
|
|


