 |
Приборы, необходимые для выполнения работы
|
|
|
|
Прибор Клемана - Дезорма, с помощью которого можно определить величину  (рис.1). Он представляет собой баллон A с воздухом, накачиваемым компрессором K, до некоторого давления P, избыток которого DР = Р - Р0 над атмосферным р0 определяется по водяному манометру, соединённому с баллоном шлангом,
(рис.1). Он представляет собой баллон A с воздухом, накачиваемым компрессором K, до некоторого давления P, избыток которого DР = Р - Р0 над атмосферным р0 определяется по водяному манометру, соединённому с баллоном шлангом,
DР = rgh
Для осуществления быстрого (адиабатного) расширения воздуха из баллона в атмосферу служит ручной клапан Кл.
Выделим (мысленно) внутри воздуха, находящегося в баллоне А, некоторую массу газа m и проследим за изменением её состояния во время опыта при одновременном изменении давления Р и температуры Т.
Если клапан Кл открыт, то давление в сосуде равно атмосферному Р0; температура воздуха в сосуде равна T0 - температуре окружающей среды. Тогда параметрами мысленно выделенной массы воздуха будут V0, P0, T0, где V0 - объём рассматриваемой массы воздуха при давлении P0 и температуре T0.
Если теперь закрыть клапан Кл и накачать с помощью компрессора в сосуд некоторое количество воздуха, то рассматриваемая нами масса воздуха сожмётся, а температура и давление её повысятся. Через некоторое время, вследствие теплообмена с окружающей средой, температура воздуха в сосуде станет равной T0. Давление же будет равно:
P1 = P0 + rgh1, (10)
где h1 - окончательная (после установления теплового равновесия с окружающей средой) разность уровней жидкости в манометре.
Состояние рассматриваемой массы воздуха определяется теперь параметрами V1, P1, T0 - это 1-ое состояние выделенной массы воздуха; V1 - объём рассматриваемой массы воздуха при давлении P1 и температуре T0.
Если на короткое время (~ 1÷2 с) открыть клапан Кл (рис. 1), то воздух, находящийся в баллоне, быстро (адиабатно) расширится и вследствие этого охладиться. В конце этого малого промежутка времени, в течение которого клапан Кл открыт и баллон сообщается с атмосферой, давление воздуха внутри сосуда станет равным давлению атмосферы P0, и состояние рассматриваемой массы воздуха будет определяться в этот момент следующими параметрами:
|
|
|
теплоемкость газ адиабата
. 
Рис.1
V2, P0, T1 - 2-ое состояние выделенной массы воздуха, где V2 - объём выделенной массы воздуха. При этом T1 < T0.
Когда давление в сосуде А сделается равным давлению атмосферы (~ 1÷2 с) клапан Кл закрывают. Воздух, находящийся в баллоне, начнёт нагреваться от T1 до T0 вследствие получения тепла от окружающей среды, давление в сосуде начнёт повышаться и станет равным:
P2 = P0 + rgh2, (11)
где h2 - разность уровней жидкости в манометре после того, как температура газа в баллоне станет равной температуре окружающей среды.
Рассматриваемая масса воздуха теперь характеризуется параметрами V2, P2, T0 - это 3-е состояние рассматриваемой массы воздуха.
Итак, рассматриваемая масса воздуха во время опыта находилась последовательно в трёх состояниях:
. V1, P1, T0 2. V2, P0, T1 3. V2, P2, T0
Переход из первого состояния во второе происходит адиабатно, а точки состояний 2 и 3 лежат на изохоре. На рис.2 изображены графики процессов: кривая 1-2 - адиабата, кривая 2-3 - изохора, кривая 1-3 - изотерма. Газ в состояниях 1-3 имеет одинаковую температуру T0.
Переход из состояния 1 в состояние 2 описывается уравнением Пуассона:
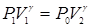 . (12)
. (12)
Параметры 1-го и 3-го состояний удовлетворяют закону Бойля - Мариотта:
P1V1 = P2V2. (13)

Возведя уравнение (13) в степень γ и разделив его почленно на (12), получим
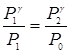 ,
,
Отсюда
 . (14)
. (14)
Учитывая равенства (9) и (10), получаем, что
P0 = P1 - rgh1, P2 = P1 - rg(h1 - h2)
и подставляя их в равенство (14), имеем
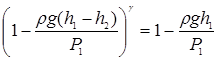 . (15)
. (15)
Так как rg(h1 - h2) << P1, то разложив левую часть (15) в ряд и ограничившись первым членом разложения, получим
|
|
|
 . (16)
. (16)
Приравняв правые части (14) и (15), получим следующую формулу:
 ,
,
которая используется в этой работе для экспериментального определения γ.
Порядок выполнения работы
1. При закрытом клапане Кл компрессором осторожно накачивают воздух в баллон А до разности уровней жидкости в манометре 30 - 35 см.
2. Выжидают 2 - 3 минуты, пока уровни жидкости в манометре не перестанут изменяться; затем отсчитывают их разность h1 с точностью до 1 мм.
3. Открыв клапан Кл выпускают из баллона воздух. Клапан остаётся открытым в течение 1-2 секунд, пока не прекратится шипение выходящего из баллона А воздуха, после чего клапан Кл закрывают.
4. Выжидают минуты 2 - 3, следя за изменением уровней жидкости в манометре; когда уровни установятся, берут отсчёт разностей уровней жидкости в манометре h2.
5. Опыт проделывают не менее десяти раз. Результаты измерений записывают в таблицу.
6. Рассчитать абсолютную и относительную погрешность полученного результата.
Окончательный результат записать в виде 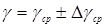 .
.
Таблица
| № измерения | Разность уровней жидкостей в манометре h1, мм | Разность уровней жидкости в манометре h2, мм | h1 - h2, мм | 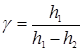 Δγ Δγ
| |
| 1. | |||||
| 2. | |||||
| 3. | |||||
| 9. | |||||
| Среднее значение | |||||
Контрольные вопросы
7. Дайте определение удельной и молярной теплоёмкости при:
а) постоянном давлении; б) постоянном объёме.
8. Выведите соотношение между теплоёмкостями при постоянном давлении и постоянном объеме.
9. Какие процессы изменения состояния воздуха имеют место в данной работе?
10.Чему равен показатель адиабаты γ в уравнении Пуассона? Каково его численное значение для одноатомного и многоатомного газов?
11.Вычислите теоретическое значение γ для воздуха, считая воздух идеальным двухатомным газом.
12.Какой процесс называется адиабатным? Выведите уравнение адиабатного процесса.
13.Какие процессы называются изохорным, изотермическим, изобарным? Нарисуйте в диаграмме P, V графики этих процессов.
14.Чему равна теплоемкость в изотермическом и адиабатном процессах?
|
|
|
15.Как меняется внутренняя энергия газа при адиабатном процессе?
16.Как меняется температура газа при адиабатном процессе?
17.Выведите формулу, выражающую зависимость молярной теплоёмкости идеального газа при постоянном давлении от числа степеней свободы молекулы.
Литература
1. Детлаф А.А., Яворский Б.М. Курс физики М.: Высш. шк., 2002. с. 114-125, 146-148.
2. Савельев И.В. Курс общей физики. Т.1. - М.: Наука, 1977, §§ 87, 88, 97.
. Зисман Г.А., Тодес О.М. Курс общей физики. Т.1. - М.: Наука, 1972, §§ 32, 33.
|
|
|


