 |
Глава 15. Биофизика сложных систем.
|
|
|
|
Что такое биофизика сложных систем? Все области биологии явно или неявно занимаются изучением сложных систем. Однако, в последние годы все большее значение начал приобретать количественный, всеохватывающий (без априорных упрощений и редукций) анализ сложных биологических систем, ставший возможным благодаря прогрессу биохимии, молекулярной биологии, компьютерных технологий. Область исследований, объединенных такой задачей, получила название системной биологии, и включила в себя ранее существовавшие задачи исследования полиферментных систем, математической биологии, метаболического контроля и другие. В России существует устоявшийся термин "биофизика сложных систем", который в значительной степени перекликается с современный определением системной биологии.
В настоящее время системно-биологические подходы играют непрерывно увеличивающуюся роль в медицине, фармакологии, диагностике, биоинженерии. Понимание механизмов действия лекарств и разработка новых, интерпретация данных диагностических методов, исследование природы заболевания, выявление мишеней для терапии в своей или враждебной клетке, поиск мишений для генно-инженерной модификации — вот только основной список задач, в которых активно используется математическое моделирование.
Однако, в силу специфики биологических систем, их моделирование осуществляется с помощью довольно специальных, характерных только для биологии подходов.
Общие подходы к моделированию. В системной биологии выделяют два принципиальных подхода к анализу систем — каузальный (causal) и вероятностный (probabilistic). Первый подход подразумевает создание четко определенной модели системы, обычно уже неплохо изученной, с использованием как детерминистических, так и стохастических приемов (дифференциальные уравнения, булевы сети и т.п.). Затем эта модель анализируется. Напротив, вероятностный подход применяется тогда, когда устройство системы известно плохо, и именно его пытаются выявить на основании большого объема экспериментальных данных. Для этого используются различные самообучающиеся и распознающие алгоритмы (например, нейронные сети). Разумеется, эти два подхода не являются взаимоисключающими: теоретик может и должен всегда подозревать, что данные о системе неполны или неправильны, и всегда должен быть готов к тому, что поведение модели разойдется с экспериментом, так что представление об устройстве системы придется пересматривать. Тем не менее, между поиском нестыковок в хорошо изученной системе и выявлением устройства системы почти с нуля есть принципиальная разница, и именно она определяет выбор общей стратегии.
|
|
|
Каузальные подходы наиболее понятны и распространены, и только они будут далее здесь рассматриваться.
Их можно разделить на количественные и качественные. Количественные методы подразумевают создание полноценной модели исследуемой системы, основанной на дифференциальных уравнениях или стохастических алгоритмах. Качественные методы, такие как стехиометрический анализ, изучают только структуру системы (как правило, с помощью анализа матриц, основанных на стехиометрии реакций), позволяя получить полезную информацию о ее устройстве, регуляции, параметрах даже в тех случаях, когда значения скоростей реакций и концентрации веществ изначально неизвестны.
С точки зрения физического устройства моделируемой системы, особое внимание уделяется разделению на гомогенные (точечные, пространственно однородные), реакционно-диффузные (пространственно неоднородные) и реакционно-диффузно-конвекционные модели. В системной биологии различие между стационарными и нестационарными системами играет колоссальную роль, и является причиной того, что обширный арсенал ее методов до сих пор редко применяется в изучении свертывания. Дело в том, что в этом арсенале есть множество детально проработанных приемов, предназначенных для изучения стационарных и квазистационарных метаболических систем, но мало эффективных способов анализа систем нестационарных, а тем более пространственно неоднородных. В дальнейшем рассмотрении мы бегло пройдемся по стационарным подходам ввиду их распространенности, исторической и методологической важности; а затем рассмотрим те подходы, которые существуют для нестационарных систем.
|
|
|
Методы исследования стационарных систем. Основой методологии количественного исследования стационарных гомогенных систем является теория метаболического контроля или же анализ метаболического контроля (АМК), которая была создана и успешно применялась задолго до того, как появился термин "системная биология". Первые работы Хиггинса по многоферментным системам, опубликованные в 1963 г., считаются важнейшим этапом на пути к появления этого метода; но его создателями считаются Каксер и Хайнрих, которые в 1973-74 гг. сформулировали и доказали первые теоремы АМК.
АМК в своем классическом виде базируется на ряде допущений:
1. Все реакции изучаемой системы связаны между собой посредством метаболитов.
2. Система находится в устойчивом стационарном состоянии.
3. Метаболиты и ферменты гомогенно распределены в пространстве.
4. Концентрации ферментов являются константами-параметрами, а не переменными.
5. Скорости работы ферментов пропорциональны их концентрациям, один фермент влияет на одну реакцию.
Такие допущения сужают круг применимости метода, практически исключая из него любые нестационарные системы наподобие клеточной сигнализации или свертывания крови; а оставшиеся системы могут исследоваться только в области стационарных состояний. Зато для такого узкого круга систем возможно получение значительного количества фундаментальных и прикладных результатов.
Главным параметром АМК является коэффициент контроля, вводимый следующим образом. Если система находится в стационарном состоянии, то все концентрации и скорости реакций постоянны. Более того, условие постоянства концентраций ведет к тому, что все реакции в неразветвленном ферментативном пути имеют одинаковую скорость, и ее можно назвать потоком через систему. Малые изменения в параметрах системы приводят к малым возмущениям в концентрациях и потоках, и величина этих возмущений указывает на то, насколько контролирующим является тот или иной параметр. Коэффициент контроля потока определяется:
|
|
|
 , (1)
, (1)
где Ji — скорость i -й реакции (или поток, если путь неразветвленный), а Ej — концентрация j -го фермента. По аналогии, концентрационный коэффициент контроля имеет вид:
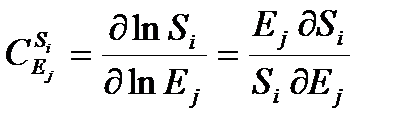 , (2)
, (2)
где Si — концентрация i -го метаболита.
Наличие логарифма под знаком производной приводит к тому, что коэффициенты контроля являются безразмерными и выражают относительную, а не абсолютную чувствительность. В терминах коэффициентов контроля выражаются основные теоремы АМК. Например, одна из теорем суммирования гласит, что для каждого потока сумма коэффициентов по всем ферментам равна единице — ферменты конкурируют между собой в управлении потоком.
В 1984 году было произведено официальное согласование АМК и введены единые определения. В 1989 году один из создателей теории обобщил ее на некоторые зависящие от времени процессы (преимущественно релаксиционные и колебательные; концентрации ферментов по-прежнему должны были быть постоянными), введя новый временной коэффициент контроля. В 2003 году Вестерхофф и Холоденко обобщили ее на пространственно неоднородные процессы, с теми же ограничениями. В настоящий момент АМК продолжает использоваться, до некоторой степени развиваться, влиять на новые методы. Но если какое-то время он безраздельно доминировал, то сейчас находится далеко не на первых ролях по причине принципиальной неприменимости к нестационарным задачам с переменной концентрацией ферментов наподобие внутриклеточной сигнализации.
|
|
|
В период зарождения АМК существовало много альтернативных методов, но они были большей частью забыты или влились в АМК. Одним из исключений является теория биохимических систем, до некоторой степени аналогичная АМК, но имеющая ряд интересных отличий, изменяющих область ее применения. Ввиду того, что она также неприменима для нестационарных систем, мы не будем останавливаться на ней подробнее.
Методы исследования нестационарных систем. Наиболее общим методом исследования математических моделей любого рода для систем любого типа и уровня сложности, является анализ чувствительности. В его основе лежит та же базовая идея, что и в АМК: изменяя параметры системы и наблюдая за ее ответом, можно сделать полезные выводы о роли различных компонентов системы в ее регуляции, о важности и неважности этих компонентов, о существенности или несущественности параметров с плохо определенными значениями.
В отличие от АМК, в анализе чувствительности существует множество способов определения коэффициентов чувствительности в зависимости от стоящей задачи: это могут быть простые производные; это могут быть производные, нормированные на среднее значение (как в уравнениях выше); или же на среднеквадратичное отклонение. Для нестационарных систем вводятся динамические, зависящие от времени коэффициенты чувствительности. Кроме того, обобщенный анализ чувствительности допускает возмущение более чем одного параметра одновременно, позволяя выявлять взаимодействие и корреляцию между различными компонентами системы. Наконец, в общем случае анализ чувствительности не ограничивается локальными возмущениями и коэффициентами-производными, а исследует поведение системы во всем диапазоне возможных значений параметров.
Вторым общим методом исследования сложных систем является редукция — упрощение исходной сложной математической модели, уменьшающее ее размер, но сохраняющее основные свойства системы. Существуют две стратегии редукции, применимые к сложным системам произвольной природы:
1) Выявление несущественных компонентов системы (например, с помощью анализа чувствительности) и последующее их отбрасывание.
2) Определение характерных времен для всех переменных в системе и разделение их на группы по этому признаку, выявление временной иерархии процессов в системе. В своем наиболее строгом виде эта процедура опирается на теорему Тихонова и включает в себя обезразмеривание системы, выделение малых параметров при старшей производной и разделение переменных на группы в зависимости от величин малых параметров. Для каждой группы со своим характерным временем можно считать, что более медленные переменные являются константами, в то время как более быстрые процессы (при соблюдении ряда условий) достигают квазистационарного состояния; и тогда для более "медленной" шкалы времени они описываются не дифференциальными, а алгебраическими уравнениями. В идеальном случае большая система может быть редуцирована до 2-3 дифференциальных уравнений, которые гораздо проще анализировать. Важно отметить, что ценными дополнительными инструментами в редукции могут быть замена или группировка переменных; применение теоремы Тихонова к таким новым переменным может оказаться особенно удобным.
|
|
|
Кроме этих универсальных подходов, существуют некоторые специальные способы редукции, применимые только к сложным биологическим сетям особого вида: например, предназначенные для борьбы с комбинаторной сложностью, возникающей в системах внутриклеточной сигнализации из-за присутствия белков со множественными сайтами связывания.
Еще один способ борьбы со сложностью биологических систем — выявление в них функциональных и структурных модулей. Вообще говоря, нет никакой гарантии, что в произвольной сложной системе в принципе возможно выделить сколько-нибудь изолированные подсистемы. Скорее наоборот, когда мы видим сложную многосоставную химическую реакцию небиологической природы, наподобие реакции Белоусова-Жаботинского, мы не вправе ожидать существования в ней модульности или иерархической структуры. Однако, сложные биологические системы принципиально отличаются от сложных систем, изучаемых в химии или физике. Они предназначены для выполнения четко определенных функций и задач, они не образовались случайно, а являются плодом сотен миллионов лет эволюции и жесточайшего отбора (например, система свертывания почти полностью сформировалась более полумиллиарда лет назад и с тех пор почти не изменялась). И потому мы вправе ожидать, что такие системы будут устроены не случайным, а закономерным образом; и, действительно, некоторые примеры детального исследования иерархической структуры в полиферментных системах уже стали классическими.
Гипотеза о модульности в биологии пока что не поднялась в ранг теории, несмотря на огромный опыт наблюдения модульной структуры на всех уровнях организации биологических систем, от белков до органов и даже за пределами этого диапазона. Одна из фундаментальных проблем здесь связана с тем, что у биологической модульности пока нету убедительного объяснения: подавляющее большинство математических моделей эволюционного процесса дают решения, не имеющие модульной структуры. В последнее время было предложено несколько интересных сценариев происхождения модульности, таких как ее эволюционное преимущество при адаптации к новым задачам и занятии новых экологических ниш, при изменениях окружающей среды.
Отсутствие общепринятого теоретического объяснения не мешает модульной концепции успешно использоваться в решении задач по исследованию конкретных систем, в том числе на уровне полиферментных систем. Во многих работах в таких системах пытаются выделить модули с определенными функциями — "сенсоры", "переключатели", "осцилляторы", "эффекторы". У модульного анализа есть несколько важных достоинств: он, как сейчас предполагается, применим к практически неограниченному кругу биологических систем; он ориентирован на фундаментальную особенность, отличающую биологические системы от не-биологических; он интуитивно понятен и позволяет выразить результаты работы в удобном для восприятия и использования виде. Но пока что на его пути есть труднопреодолимое препятствие: не существует универсального, объективного и простого способа выделить модули в большой системе.
|
|
|


