 |
Типы термодинамических процессов (изотермические, изобарные, изохорные)
|
|
|
|
Изотермические: T=const,  = 0 (при постоянной температуре)
= 0 (при постоянной температуре)
Изохорические: V = const,  =0 (при постоянном объёме)
=0 (при постоянном объёме)
Изобарические: P = const,  =0 (при постоянном давлении)
=0 (при постоянном давлении)
Жизнедеятельность человека протекает при постоянстве температуры и давления, то есть изобарно-изотермические условия.
Стандартное состояние
Стандартные состояния — в химической термодинамике условно принятые состояния индивидуальных веществ и компонентов растворов при оценке термодинамических величин.
Для газообразного вещества – состояние чистого вещества в газовой фазе, в котором оно имеет свойства идеального газа и давление 1 атм.
Для растворенного вещества в твердом или жидком растворе – состояние вещества в растворе со стандартной концентрацией 1 моль/дм3, имеющем свойства бесконечно разбавленного раствора.
Билет 2. Первое начало термодинамики. Энтальпия. Стандартная энтальпия образования вещества, стандартная энтальпия сгорания вещества. Стандартная энтальпия реакции. Закон Гесса и следствия из него. Применение первого начала термодинамики к биосистемам.
Первое начало термодинамики
Закон сохранения и превращения энергии:
· Энергия не создаётся и не уничтожается, возможны лишь превращения энергии из одного вида в другой в строго эквивалентных количествах (сформулирован Майером и Джоулем)
· Вечный двигатель первого рода невозможен, так как невозможно создать такой двигатель, который совершил бы работу без затрат энергии
· Если к закрытой системе подвести теплоту (Q), то эта энергия расходуется на увеличение внутренней энергии ( ) и совершение работы (A) против внешних сил окружающей среды
) и совершение работы (A) против внешних сил окружающей среды

 – против внешнего давления
– против внешнего давления

Следствия первого начала термодинамики:
|
|
|
1) В изобарных условиях (при P=const)
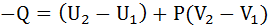

 энтальпия (H)
энтальпия (H)
 ;
;  ;
;  (
( – термодинамический параметр)
– термодинамический параметр)
Энтальпия
Энтальпия – термодинамическая функция, характеризующая энергетическое состояние системы при изобарно-изотермических условиях. Это часть внутренней энергии системы, которая может быть переведена в тепло.

2) Для изохорного процесса (V=const), 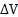 =0
=0

 , (
, ( - термодинамический параметр)
- термодинамический параметр)
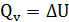
В изохорном процессе тепло, сообщаемое системе, расходуется только на приращение внутренней энергии системы.
3) Для изотермического процесса (T = const),  =0:
=0:
 (
( – термодинамический параметр)
– термодинамический параметр)
В изотермическом процессе тепло, сообщаемое системе, расходуется только на работу.
4) Для адиабатического процесса:
Q=0 или  =0:
=0:
 = -A
= -A
Работа производится только за счёт внутренней энергии системы, обмена теплотой нет
Стандартная энтальпия образования вещества, стандартная энтальпия сгорания вещества.
Стандартная энтальпия образования вещества – равна энтальпии реакции получения 1 моль этого вещества из простых веществ при стандартных условиях
Стандартная энтальпия сгорания вещества (∆Н0с) – равна энтальпии реакции сгорания 1 моль вещества при стандартных условиях до образования устойчивых оксидов.
Закон Гесса
 Энтальпия химической реакции, протекающей при постоянном объёме или при постоянном давлении, зависит только от природы и состояния исходных веществ и конечных продуктов и не зависит от числа и последовательности промежуточных стадий при условии, что теплоты измерены при одинаковых температурах.
Энтальпия химической реакции, протекающей при постоянном объёме или при постоянном давлении, зависит только от природы и состояния исходных веществ и конечных продуктов и не зависит от числа и последовательности промежуточных стадий при условии, что теплоты измерены при одинаковых температурах.


Следствия закона Гесса:
1) Энтальпия химической реакции равна разности сумм стандартных энтальпий образования продуктов реакции и исходных веществ

2) Энтальпия химической реакции равна разности сумм стандартных энтальпий сгорания исходных веществ и продуктов реакции
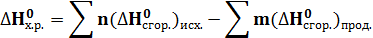
3) Энтальпия прямой реакции равна энтальпии обратной реакции, но с противоположным знаком
|
|
|

|
|
|


