 |
Выбор темы реферата. Формулировка названия
|
|
|
|
Работа над рефератом начинается с выбора темы. Тему реферата может предложить преподаватель или сам студент на основании своего научного интереса, ориентируясь на список тем, данный в приложении 1, в последнем случае она должна быть согласованна с преподавателем. В большинстве случаев тема реферата и его название совпадают.
3.2. Разработка предварительного плана реферата
План реферата характеризует его содержание и структуру. Причем структура должна включать в себя следующие разделы:
- Введение, где обосновывается актуальность проблемы, ставятся цель и задачи исследования. Для написания введения используется новейшие литературные данные.
- Основная часть, в которой раскрывается содержание темы реферата. Здесь обязательно должны присутствовать следующие подразделы:
· общая характеристика класса химических соединений, к которым относится исследуемое вещество. В этом подразделе приводится определение данного класса органических соединений, классификация, номенклатура;
· способы получения. В этом подразделе приводятся как классические литературные способы получения, так и новые, нетрадиционные способы, сообщения о которых встречаются в научной периодической печати. Обязательно написание всех схем химических реакций и названий исходных веществ и продуктов. Где возможно, приводятся механизмы реакций.
В качестве примера рассмотрим способы получение изопропилового спирта (пропанола-2):
1. Гидролиз галогенпроизводных. В результате реакции нуклеофильного замещения при взаимодействии 2-хлорпропана с водным раствором щёлочи образуется изопропиловый спирт:
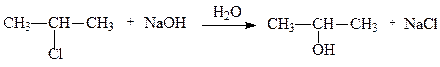 (3.1)
(3.1)
Условия протекания реакции существенно зависят от строения радикала и природы галогена. В случае вторичных галогенпроизводных наблюдается смешанный механизм реакции (нуклеофильное замещение моно- и бимолекулярное).
|
|
|
2. Восстановление альдегидов и кетонов. При восстановлении альдегидов образуются первичные спирты, кетонов – вторичные. Для получения изопропилового спирта восстановлению нужно подвергнуть пропанон (ацетон). В качестве восстановителей используются комплексные гидриды металлов – алюмогидрид лития LiAlH4, борогидрид натрия NaBH4 и их производные, а также водород в присутствии катализаторов:
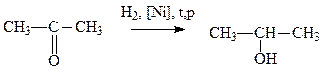 (3.2)
(3.2)
3. Присоединение воды к алкенам (гидратация алкенов). При присоединении воды к этилену образуется первичный спирт, при гидратации его гомологов в соответствии с правилом Марковникова – вторичные или третичные спирты. Реакция гидратации пропена лежит в основе промышленного метода синтеза изопропилового спирта:
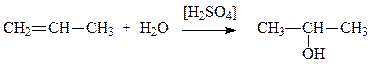 (3.3)
(3.3)
Рассмотрим механизм этой реакции.
На первой стадии атака молекулы пропена протоном приводит к разрыву π- связи и образованию σ-комплекса, а именно карбкатиона. Это медленная стадия, определяющая скорость процесса в целом. В динамическом состоянии, т.е. в процессе реакции, из двух возможных карбкатинов (первичного и вторичного) будет образовываться наиболее стабильный. В карбкатионе положительно заряженный атом углерода находится в sp2-гибридном состоянии. Алкильные группы, обладающие + I -эффектом, понижают положительный заряд. Поэтому вторичный карбкатион стабильнее первичного. На второй стадии образующийся вторичный карбкатион взаимодействует с молекулой воды, обладающей нуклеофильными свойствами за счет неподеленной пары электронов на атоме кислорода. На третьей, наиболее быстрой стадии, происходит отщепление протона от пропилоксониевого иона вследствие кислотно-основного взаимодействия:
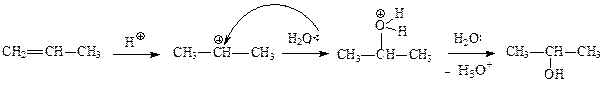
(3.4)
Таким образом, наличие кратной связи или электронодонорных заместителей в субстрате обуславливает протекание реакции через образование наиболее стабильного карбкатиона.
|
|
|
Если в ненасыщенном соединении содержится электроноакцепторный заместитель, то присоединение воды происходит против правила Марковникова. Например, при гидратации ненасыщенной пропеновой (акриловой) кислоты получается β-гидроксипропановая кислота. В этом случае реакция также протекает по пути образования наиболее стабильного карбкатиона:
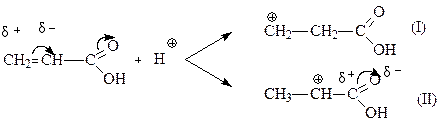 (3.5)
(3.5)
(Примечание: символами δ+ и δ- обозначены частичный положительный и частичный отрицательный заряды соответственно.)
Карбкатион I стабильнее карбкатиона II, в структуре которого одноименные заряды расположены на соседних атомах углерода, поэтому дальнейшее присоединение воды происходит следующим образом:
 (3.6)
(3.6)
· физические свойства исследуемого вещества или группы веществ. В этом подразделе указывается агрегатное состояние вещества, его внешний вид, температуры кипения и плавления, показатель преломления, плотность, растворимость в полярных и неполярных растворителях;
· химические свойства вещества. Пояснить, чем определяется его химическое поведение, рассмотреть электронное строение и взаимное влияние атомов, составляющих молекулу исследуемого соединения; привести примеры химических взаимодействий, механизмы реакций, выделить химические особенности соединения или класса соединений.
В качестве примера рассмотрим процесс взаимодействия изопропилового спирта и этановой (уксусной) кислоты. Этот процесс называется этерификаций, поскольку он приводит к образованию сложного эфира (Ether) - изопропилацетата:
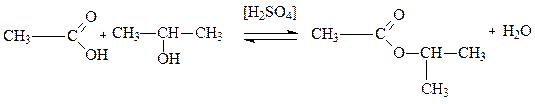 (3.7)
(3.7)
Процесс этерификации является кислотнокатализируемой ацильной бимолекулярной реакцией. Рассмотрим механизм этой реакции. На стадии катализа протонируется карбонильный атом кислорода молекулы карбоновой кислоты; гидроксильная группа не присоединяет протон, потому, что неподеленная пара электронов атома кислорода находится в сопряжении с карбонильной группой. Возникший карбкатион (I) обладает значительно более сильными электрофильными свойствами, чем исходная карбоновая кислота, и поэтому может присоединить даже слабый нуклеофил, каким является молекула спирта. В образовавшемся карбкатионе (II) происходит перенос протона к одной из гидроксильных групп, и при этом формируется хорошая уходящая группа – молекула воды. После отщепления воды от катиона (III) и возврата катализатора образуется сложный эфир:
|
|
|
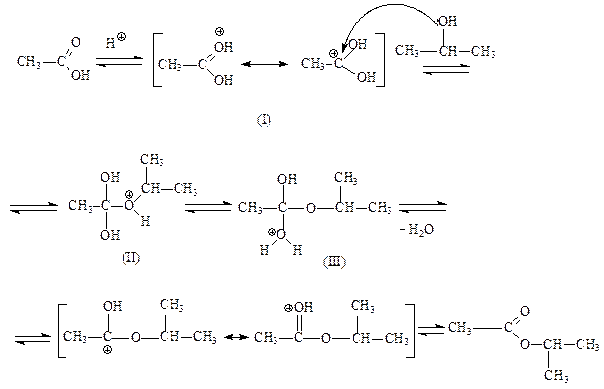
(3.8)
Все стадии реакции этерификации обратимы; обратная реакция представляет собой катализируемый кислотой гидролиз сложных эфиров. При получении сложного эфира смещение равновесия вправо достигается путем отгонки воды или образующегося эфира;
· области применения – традиционные и новейшие; влияние на организм человека и экологическую обстановку в целом. Перспективы развития производств по его получению и переработке.
- заключение, где обобщаются выводы по теме и даются практические рекомендации по перспективам использования исследуемого соединения или класса соединений в конкретных отраслях народного хозяйства.
|
|
|


