 |
Окислительно-восстановительное титрование (редоксиметрия)
|
|
|
|
1. 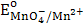 = 1,51 В. Восстановить
= 1,51 В. Восстановить 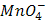 - в кислой среде (ответ поясните) может…
- в кислой среде (ответ поясните) может…
1. KBrO3; 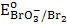 = 1,52 В
= 1,52 В
2. Na2C2O4; 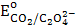 = 0,49 B
= 0,49 B
3. H2O2; 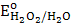 = 0,77 B
= 0,77 B
4. Na2S4O8; 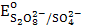 = 2,0 B
= 2,0 B
5. F2; 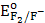 -= 2,87 B
-= 2,87 B
2. Окислительно-восстановительные индикаторы – это органические аналитические реагенты, которые изменяют свою окраску при …
1. определенном значении потенциала
2. образовании комплексного соединения с титрантом
3. изменении pH
4. образовании комплексного соединения с титруемыми ионами
3. Автокаталитической называется реакция …
| 17. один из реагентов которой является катализатором этой реакции; |
| 18. один из продуктов которой является катализатором этой реакции; |
| 19. которая протекает без участия катализатора; |
| 20. в которой точку эквивалентности фиксируют по изменению окраски одного из участников реакции |
4. Действием азотной кислоты ( = + 0,94 В) можно окислить:
= + 0,94 В) можно окислить:
1. Mn2+ ; 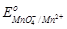 = + 1,51 В. = + 1,51 В.
| 3. F–; 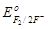 = + 2,87 В. = + 2,87 В.
|
2. Br–; 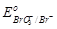 = + 1,45 В. = + 1,45 В.
| 4. I–; 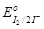 = + 0,54 В. = + 0,54 В.
|
5. Способ фиксирования точки эквивалентности (ТЭ) в перманганатометрии:
1. рН-индикатор;
2. металлоиндикатор;
3. безиндикаторный;
4. редокс-индикатор;
6. Продукты реакции FeSO4+KMnO4+H2SO4→
1. Fe2(SO4)2
2. MnSO4
3. MnO2
4. K2SO4
5. H2O
6. K2MnO4
Напишите уравнение реакции, расставьте коэффициенты.
7. Титрант в перманганатометрии:
1. KMnO4;
2. MnSO4;
3. Fe SO4;
4. Na2S2O3;
5. Na2S2O3;
6. KBrO3;
8. При титровании раствора щавелевой кислоты раствором перманганата калия изменяется:
| 1. Е | 3. рК |
| 2. рН | 4. рМе |
9. Методом прямого перманганатометрического титрования в растворе можно определить
1. сульфат железа (II)
2. дихромат калия
3. щавелевую кислоту
4. уксусную кислоту
10. Укажите стехиометрический коэффициенты перед окислителем в реакции FeSO4 + KMnO4 + H2SO4 ®
11. Титрант метода иодометрия (несколько вариантов):
|
|
|
1. Сульфат железа
2. Тиосульфат натрия
3. Комплексон III
4. Гидроксид натрия
12. Вещество, которое нельзя восстановить действием Na2S2O3.
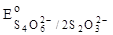 = + 0,09 В.
= + 0,09 В.
1. CO2; 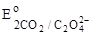 = - 0,49 B. = - 0,49 B.
|
2. I2; 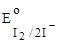 = + 0,54 B. = + 0,54 B.
|
3. FeCl3; 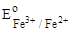 = + 0,77 B. = + 0,77 B.
|
4. KMnO4; 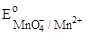 = + 1,51 B. = + 1,51 B.
|
13. Титранты метода иодометрии (несколько вариантов):
| 1. I2 | 2. Na2S2O3 |
| 3. KI | 4. KIO3 |
14. При определении окислителей методом иодометрии в качестве способа титрования, стандартного вещества и индикатора применяют …
| Способ титрования | Стандартное вещество | Индикатор | ||
| 1. Прямое | 1. Н2С2О4 | 1. крахмал | ||
| 2. Заместительное | 2. Н2С2О4 · Н2О | 2. фенолфталеин | ||
| 3. Обратное | 3. Na2S2O3 | 3. эриохромовый черный Т | ||
| 4. K2Cr2O7 | 4. безиндикаторное титрование | |||
| 5. крахмал | 5. дифениламен |
15. Скачок на кривой титрования в редоксиметрии при использовании в качестве индикатора эриоглауцина (Е0ind = 1,00 В) составляет
1. 0,60….....1,00
2. 0,80….....1,40
3. 1,10….....1,31
4. 0,60….....0,90
16. Почему для подкисления растворов в перманганатометрии не применяется HCl, а в основном H2SO4?
1. Происходит реакция окисления хлорид-ионов перманганат-ионами
2. Улетучивается часть хлора, образовавшегося в результате окисления хлорид-ионов
3. Повышается расход перманганата калия на титрование анализируемого вещества
4. Объясняется всеми вышеперечисленными причинами.
17. Какой ион можно окислить KMnO4 в кислой среде? 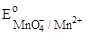 = + 1,51 В.
= + 1,51 В.
1. Bi3+; 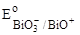 = + 1,80 B. = + 1,80 B.
|
2. NO2–; 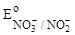 = + 0,94 B. = + 0,94 B.
|
3. SO42–; 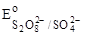 = + 2,01 B. = + 2,01 B.
|
4. F–; 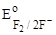 = + 2,87 B. = + 2,87 B.
|
18. Найдите стехиометрический коэффициент перед окислителем в реакции
KMnO4 + H2C2O4 + H2SO4 → MnSO4 + CO2 + K2SO4 + H2O.
| 1. 10. | 3. 2. |
| 2. 1. | 4. 5. |
19. На титрование 10,00 см3 раствора иода затрачено 9,50 см3 раствора тиосульфата натрия с концентрацией с(1/1Na2S2O3) = = 0,01 моль/дм3. Вычислите массу (г) I2 в 100 см3 раствора.
| 1. 0,2413. | 3. 0,1207. |
| 2. 0,1501. | 4. 12,07. |
20. В какой последовательности окисляются ионы перманганатом?
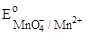 = + 1,51 В.
= + 1,51 В.
|
|
|
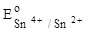 = + 0,15 В, = + 0,15 В,
| 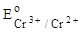 = – 0,41 В, = – 0,41 В,
| ||
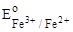 = + 0,77 В. = + 0,77 В.
| |||
| 1. Fe2+, Sn2+, Cr2+. | 3. Sn2+, Cr2+, Fe2+. | ||
| 2. Cr2+, Fe2+, Sn2+. | 4. Cr2+, Sn2+, Fe2+. | ||
21. На титрование раствора 7,00 см3 I2 c титром 0,01270 г/см3 затрачено 10,00 см3 раствора Na2S2O3. Молярная концентрация раствора тиосульфата натрия составляет ____ моль/дм3.
22. Способ фиксирования ТЭ в иодометрии:
1. рН-индикатор;
2. специфический индикатор крахмал;
3. безиндикаторный;
4. редокс-индикатор
Комплексонометрия
1. В аналитических лабораториях общую жесткость воды определяют методом ______________титрования.
1. кислотно-основного
2. окислительно-восстановительного
3. осадительного
4. комплексонометрического
2. Фиксирование точки эквивалентности при титровании воды раствором комплексона III в присутствии аммонийного буферного раствора и индикатора эриохромового черного Т производят при.
1. достижении титруемым раствором вино-красного цвета;
2. переходе цвета титруемой взвеси из белого в красный;
3. выпадении белого осадка;
4. достижении титруемым раствором синего цвета.
3. Фиксирование точки эквивалентности при титровании сточной воды, содержащей ионы кальция, раствором комплексона III в присутствии аммонийного буферного раствора и индикатора эриохромового черного Т производят при достижении титруемым раствором …… цвета.
1. розового
2. оранжевого
3. красного
4. синего
4. Катионы,определяемые методом комплексонометрии
1. K+
2. Mg2+
3. H+
4. Ca2+
5. Na+
6. NH4+
5. Точку эквивалентности в комплексонометрии фиксируют,
| 1. примененяя специфический индикатор |
| 2. безиндикаторным способом |
| 3. применяя фенолфталеин |
| 4. примененяя металлоиндикаторы |
6. При комплексонометрическом титровании в титруемом растворе изменяется:
| 1. рМе. | 3. рН. |
| 2. рТ. | 4. Е. |
7. Буферная смесь, применяемая в комплексонометрии, для поддержания pH>9
1. NH4OH+NH4Cl
2. CH3COOH+CH3COONa
3. HCOOH+HCOONa
4. C6H5OOH+C6H5OONH4
8. Укажите правильную формулу комплексоната магния:
1.     ООС–Н2С СН2 –СООNa ООС–Н2С СН2 –СООNa
    N–СН2 –СН2– N N–СН2 –СН2– N
 NaООС–Н2С СН2 –СОО NaООС–Н2С СН2 –СОО
  Мg Мg
|
2.      ООС–Н2С СН2 –СОО ООС–Н2С СН2 –СОО
    N–СН2 –СН2– N N–СН2 –СН2– N
 NaООС–Н2С СН2 –СОО NaООС–Н2С СН2 –СОО
  Мg Мg
 
|
3.  NaООС–Н2С СН2 –СООMg
N–СН2 –СН2– N NaООС–Н2С СН2 –СООMg
N–СН2 –СН2– N
 MgООС–Н2С СН2 –СООNa. MgООС–Н2С СН2 –СООNa.
|
4.   НООС–Н2С СН2 –СООMg
N–СН2 –СН2– N
NaООС– Н2С СН2 –СООН. НООС–Н2С СН2 –СООMg
N–СН2 –СН2– N
NaООС– Н2С СН2 –СООН.
|
|
|
|
9. Укажите правильную формулу комплексоната алюминия:
1     ООС–Н2С СН2 –СООNa ООС–Н2С СН2 –СООNa
    N–СН2 –СН2– N N–СН2 –СН2– N
 NaООС–Н2С СН2 –СОО NaООС–Н2С СН2 –СОО
  Al Al
|
2.      ООС–Н2С СН2 –СОО ООС–Н2С СН2 –СОО
    N–СН2 –СН2– N N–СН2 –СН2– N
 NaООС–Н2С СН2 –СОО NaООС–Н2С СН2 –СОО
  Al Al
 
|
3.  NaООС–Н2С СН2 –СООAl
N–СН2 –СН2– N NaООС–Н2С СН2 –СООAl
N–СН2 –СН2– N
 AlООС–Н2С СН2 –СООAl. AlООС–Н2С СН2 –СООAl.
|
4.  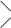 НООС–Н2С СН2 –СООAl
N–СН2 –СН2– N
NaООС– Н2С СН2 –СООН. НООС–Н2С СН2 –СООAl
N–СН2 –СН2– N
NaООС– Н2С СН2 –СООН.
|
10. На титрование 10,0 см3 минеральной воды затрачено 10,50 см3 0,020 моль/дм3 раствора комплексона III. Рассчитайте жесткость анализируемой воды (ммоль/дм3).
| 1. 21,0 | 3. 10,5 |
| 2. 42,0 | 4. 5,25 |
11. На титрование 50,00 см3 водопроводной воды затрачено 7,50 см3 0,02000 моль/дм3 раствора комплексона III. Вычислить жесткость анализируемой воды (ммоль/дм3).
| 1. 6,0. | 3. 1,5. |
| 2. 3,0. | 4. 7,5. |
12. Закончите уравнение стандартизации раствора комплексона III: Мg2+ + Н2Y2–…
 1. МgY2– + 2Н+. 1. МgY2– + 2Н+.
| 3.... МgY– + 2Н+. |
| 2.... МgY– + Н+. | 4.... МgY + 2Н+. |
13. При определении жесткости воды в колбу для титрования помещают …
| 1. раствор сульфата магния мерной пипеткой, аммонийный буферный раствор мерным цилиндром, эриохромовый черный Т на кончике шпателя; |
| 2. раствор сульфата магния и аммонийный буферный раствор мерными цилиндрами, эриохромовый черный Т на кончике шпателя; |
| 3. воду и аммонийный буферный раствор мерными пипетками, эриохромовый черный Т на кончике шпателя; |
| 4. воду мерной пипеткой, аммонийный буферный раствор мерным цилиндром, эриохромовый черный Т на кончике шпателя; |
14. Общая жесткость воды определяется присутствием
| 1. сульфатов, карбонатов К+ и Fe3+ |
| 2. сульфатов, карбонатов, гидрокарбонатов Mg2+ и Ca2+ |
| 3. хлоридов, гидрокарбонатов Mg2+ и Zn2+ |
| 4. карбонатов, гидрокарбонатов Са2+ и Al3+ |
15. Уравнение образования комплекса Ме2+ с комплексоном III: Ме2+ + Н2Y2– …
1.  ... МеY2– + 2Н+. ... МеY2– + 2Н+.
|
| 2.... МеY + 2Н+. |
| 3.... МеY– + Н+. |
| 4. … МеY2–+ Н+. |
16. Укажите метод и индикатор для определения жесткости воды:
1. Кислотно-основное титрование, эриохромовый черный Т;
2. Комплексонометрия, эриохромовый черный Т;
3. Йодометрия, крахмал;
4. Аргентометрия, хромат калия;
17. Металлиндикаторы – это аналитические реагенты, образующие окрашенные комплексы с …
|
|
|
1. титрантом
2. титрируемым ионом металла
3. ионом, входящим в состав буферной смеси
18. В процессе комплексонометрического титрования в растворе изменяется
1. pH 3. E 5. pT
2. pMe 4.pK 6.C(Me2+)
19. Соответствие между формулами комплексонов и их названиями:
1.
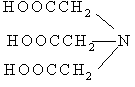
| 1. Двунатриевая соль этилендиаминтетрауксусной кислоты (ЭДТА), комплексон III |
2.
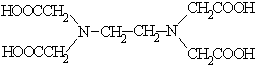
| 2. Нитрилотриуксусная кислота (НТУ), комплексон I |
3.
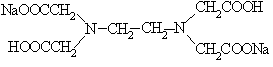
| 3. Этилендиаминтетрауксусная кислота (ЭДТУ), комплексон II |
20. Комплексонатами называют...
| 1. металлоиндикаторы |
| 2. титранты в комплексонометрии |
| 3. определяемые вещества в комплексонометрии |
| 4. циклические комплексные соединения комплексонов с металлами |
| 5. буферные растворы в комплексонометрии |
21. Комплексонометрическим методом можно определить в растворе:
1. Ca2+, Mg2+
2. Ca2+, Na2+
3. K+, Na+
4. Cu2+, K+
Написать уравнение реакции комплексообразования, находящейся в основе метода
22. Укажите метод и индикатор для определения жесткости воды
1. Кислотно-основное титрование, эозин
2. Комплексонометрия, эриохромовый черный Т
3. Йодометрия, крахмал
4. Аргентометрия, дихромат калия
23. В присутствие каких индикаторов можно селективно определить содержание ионов кальция и магния в растворе?
1. Фенолфталеин и ЭХЧ-Т 3. ЭХЧ-Т и мурексид
2. ЭХЧ-Т и эозин 4. Фенолфталиин и флуоресцин
24. Фактор эквивалентности Al3+ в реакции с ЭДТА…
1. 1/1 3. 1/3 5. 1/5
2. ½ 4.1/4 6.1/6
25. При прямом комплексонометрическом титровании окраска раствора изменяется, потому что в конечной точке титрования протекает реакция…
1. Меn+ + Ind- = МеIndn-1
2. МеIndn-1 +H2Y2 - = MеYn-4 + HInd + H+
3. Меn+ + H2Y2- = MеYn-4 + 2H+
26. Напишите уравнение реакции образования комплексоната кальция.
Укажите условия ее протекания.
27. Принцип действия металлоиндикатора при титровании заключается в изменении окраски раствора вблизи точки эквивалентности в результате
| 1. разрушения комплексоната металла |
| 2. образования комплекса металлоиндикатора с ионом титруемого металла |
| 3. разрушения комплекса металлоиндикатора с ионом титруемого металла |
| 4. образования комплексоната металла |
28. Среда, в которой возможно комплексонометрическое определение Са2+ и Mg2+.
| 1. щелочная. | 3. кислая. |
| 2. нейтральная. | 4. слабокислая. |
29. Реакция образования комплексоната железа (III) при рН = 2
1. 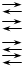 Fe 3+ + H2Y 2- FeY – + 2 H + Fe 3+ + H2Y 2- FeY – + 2 H +
|
| 2. Fe3+ + HY3- FeY– + H+ |
| 3. Fe3+ + Y4- FeY– |
| 4. Fe3+ + H3Y- FeY– + 3 H+ |
5. 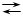 Fe 3+ + H4Y FeY – + 4 H + Fe 3+ + H4Y FeY – + 4 H +
|
23. Соли, вызывающие постоянную жесткость воды
| 1. CaCl2, BaCl2. |
| 2. Na2SO4, MgSO4. |
| 3. CaCl2, MgSO4. |
| 4. K2CO3, CaCO3. |
|
|
|


