 |
Энтерогепатическая циркуляция и экскреция желчных кислот и холестерина
|
|
|
|
Обмен и функции липопротеинов.
Поскольку жиры нерастворимы в воде и жидкостях организма, для транспорта этих веществ с кровью необходимы специальные механизмы. Транспорт осуществляется в составе особых частиц – липопротеинов.
Классификация липопротеинов.
Существует несколько классификаций липопротеинов, основанных на различиях в их свойствах: скорости флотации, ЭФ подвижности, а также на различиях в апопротеиновом составе частиц. Наибольшее распространение получила классификация, основанная на поведении ЛП в процессе ультрацентрифугирования. Согласно этой классификации различают хиломикроны (ХМ), липопротеины очень низкой плотности (ЛПОНП), липопротеины низкой плотности (ЛПНП) и липопротеины высокой плотности (ЛПВП). Различная ЭФ подвижность по отношению к глобулинам плазмы положена в основу другой классификации ЛП, согласно которой различают ХМ (остаются на линии старта подобно g-глобулинам), b-ЛП, пре-b-ЛП и a-ЛП, занимающие положение b-, a1- и a2-глобулинов, соответственно.
Строение ЛП.
Плазменные ЛП имеют сферическую форму. Внутри находится жировая “капля”, содержащая неполярные липиды (ТАГ, ЭХС) и формирующая ядро ЛП-частицы. Оно окружено оболочкой из ФЛ, НЭХС и белка. Этот поверхностный гидрофильный слой защищает гидрофобное ядро от водной среды, а также обеспечивает растворимость и транспорт ЛП-частиц в водной среде.
В составе ЛП обнаружено несколько разных белков – апопротеинов: А-I, А-II, А-IV, В-48, В-100, С-I, С-II, С-III, D, E. Для всех этих белков характерно наличие гидрофильной и гидрофобной частей. Гидрофильная часть контактирует с плазмой крови, гидрофобная – с липидами ядра ЛП.
Образование и функции ЛП.
|
|
|
ЛП образуются в клетках слизистой оболочки кишечника (ХМ и ЛПВП), в гепатоцитах (ЛПОНП и ЛПВП), в плазме крови (ЛППП и ЛПНП).
Механизмы образования ХМ и ЛПОНП имеют много общего. Апопротеин В синтезируется рибосомами в шероховатом эндоплазматическом ретикулуме и встраиваются в ЛП в гладком эндоплазматическом ретикулуме, который является основным местом синтеза ТАГ. Затем ЛП прозодят через аппарат Гольджи и освобождаются из клетки в лимфу или кровь путем экзоцитоза.
ХМ и ЛПОНП служат для транспорта жиров по кровяному руслу (за сутки они распределяют по органам и тканям 70-150 г экзогенных и эндогенных жиров), а ЛПНП и ЛПВП – для транспорта холестерина. Жиры, образующиеся в печени, упаковываются в ЛПОНП, которые поступают в кровь. Печень взрослого человека выделяет в кровь 25-50 г жиров в сутки.
Жиры, синтезирующиеся в клетках кишечника из продуктов переваривания, в этих же клетках включаются в ХМ. ХМ поступают в лимфатические капилляры кишечника, затем через лимфатические сосуды брыжейки в грудной лимфатический проток и оттуда через яремную вену в общий кровоток. Ввиду своих размеров ХМ и ЛПОНП не способны выходить из кровяного русла и проникать в межклеточное пространство. Поэтому они сначала катаболизируются под действием липопротеинлипазы (ЛПЛ), локализованной на стенках капилляров ряда органов (жировой ткани, сердца) до менее крупных частиц, называемых соответственно ремнантами ХМ и ЛППП. Для проявления активности ЛПЛ требуется апопротеин С-II. ЛПЛ гидролизует ТАГ липопротеинов, при этом освободившиеся жирные кислоты поступают в клетки жировой и мышечной тканей или связываются с альбуминами и транспортируются к отдаленным органам. Ремнанты ХМ узнаются специфическими рецепторами печени по апопротеину Е и захватываются гепатоцитами. Здесь происходит распад белкового компонента и освобождение липидов, обогащенных НЭХС.
|
|
|
ЛППП либо узнаются рецепторами ЛПНП по апо Е или апо В100 (маркерный апопротеин ЛПОНП) и захватываются периферическими клетками, либо подвергаются дальнейшему катаболизму под действием печеночной липазы (ПЛ), превращаясь в ЛПНП. ЛПНП узнаются специфическими рецепторами и захватываются клетками периферических органов. В клетках ЛПНП подвергаются распаду с выделением НЭХС. Последний на генетическом уровне вызывает репрессию гидроксиметилглутарил-КоА-редуктазы – ключевого фермента биосинтеза эндогенного ХС.
ЛПВП имеют сложное происхождение. Липидный компонент включает НЭХС и ФЛ, высвобождающиеся при липолизе ХМ и ЛПОНП, а также НЭХС, поступающий из периферических клеток. Основной апопротеин ЛПВП – апо А-1 синтезируется в печени и тонком кишечнике. Вновь синтезированные ЛПВП представлены фракцией ЛПВП3. Под действием ЛХАТ (лецитин-холестерол-ацилтрансферазы), входящей в состав ЛПВП, происходит этерификация ХС (для активации ЛХАТ требуется апо А-I) и ЛПВП3 превращаются при этом в ЛПВП2. ЛПВП2 под действием ПЛ могут снова превращаться в ЛПВП3, либо захватываться путем эндоцитоза клетками печени.
Депонирование и мобилизация жиров.
Жиры депонируются в специализированных клетках жировой ткани – адипоцитах. Жир в жировой ткани накапливается за счет двух источников: поступает из липопротеинов и образуется из глюкозы в самих адипоцитах.
Мобилизация депонированных жиров происходит путем их гидролиза до жирных кислот и глицерина тканевыми липазами или триацилглицероллипазами. Мобилизацию депонированного жира активирует адреналин, действуя по тому же механизму, как и в случае мобилизации гликогена, т.е. через каскад реакций, включающий синтез цАМФ, активацию протеинкиназы и фосфорилирование тканевой липазы.
Жирные кислоты поступают в кровь, где образуют комплекс с альбумином и в такой форме транспортируется к органам и тканям. Глицерин транспортируется в растворенном состоянии и улавливается главным образом печенью. Здесь он превращается в глицерол-3-фосфат, который может вступать в реакции глюконеогенеза или окисляться в реакциях гликолиза и общего пути катаболизма.
Ожирение
Большая часть пищевых и синтезируемых в печени жиров проходит стадию депонирования в жировой ткани. У нормально упитанного человека жиры составляют около 15% массы тела. При полном голодании этот запас расходуется в течение 5-7 недель, т.к. его хватает на значительно большее время, чем запасов гликогена. При нормальном питании количество жира в организме здорового человека не изменяется. Однако и в этих условиях жиры жировой ткани постоянно обновляются. Другими словами одновременно и постоянно происходят депонирование и мобилизация жира с равными скоростями. В результате жиры жировой ткани за несколько дней обновляются полностью. При длительном голодании и систематических физических нагрузках скорость мобилизации жиров преобладает над скоростью депонирования, и количество депонированного жира уменьшается. Наоборот, если скорость мобилизации меньше скорости депонирования, то наступает ожирение.
|
|
|
Наиболее частая причина ожирения – несоответствие между количеством потребляемой пищи и энергетическими тратами организма. Такое несоответствие возникает при чрезмерном потреблении пищи, при гиподинамии и особенно при сочетании этих двух факторов.
Важную роль в регуляции потребления и катаболизма пищи играет эндокринная система, поэтому ожирение является характерным признаком многих эндокринных заболеваний.
Биосинтез фосфолипидов
Фосфоглицеролы – основные компоненты мембранных липидов – также синтезируются из диацилглицеролов, поэтому стадии, предшествующие образованию диацилглицеролов, у биосинтеза ТАГ и фосфолипидов общие. Для синтеза фосфолипидов необходим ЦТФ, который является лимитирующим фактором этого процесса.
Синтез фосфатидилэтаноламинов, фосфатидилхолинов и фосфатидилсеринов.
Сначала активируется остаточный спирт:

Остаток фосфоэтаноламина с ЦДФ-этаноламина затем переносится на глицериновый остаток диацилглицерола:

Аналогичная последовательность реакций, в которых вместо этаноламина тмпользуется холин, приводит к образованию фосфатидилхолина. Кроме того, фосфатидилхолин может образовываться путем метилирования фосфатидилэтаноламина с использованием метильных групп S-аденозилметионина:
|
|
|
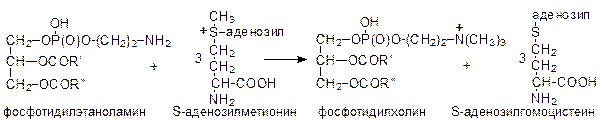
Фосфатидилсерин образуется в обменной реакции фосфатидилэтаноламина с серином:
фосфатидилэтаноламин + серин ® фосфатидилсерин + этаноламин
Синтезированные фосфолипиды переносятся с помощью липидпереносящих белков цитоплазмы к мембранам и встраиваются в них.
Обмен и функции стероидов
Основным стероидом организма человека является холестерин. Он выполняет в клетках структурную функцию, входя в состав клеточных мембран, а также является предшественником при синтезе желчных кислот, кортикостероидов, половых гормонов и витамина Д. В теле взрослого человека содержится содержится около 140 г ХС (~2 мг ХС на 1 г массы тела).
Наиболее богаты ХС нервная ткань (миелиновые мембраны) и кора надпочечников. Часть ХС тканей этерифицирована высшими жирными кислотами, обычно олеиновой кислотой. Эфиры холестерина – это, как правило, депонированная или транспортная форма ХС. Например, 75% ХС ЛП крови этерифицировано, 83% ХС этерифицировано в надпочечниках, где ЭХС депонируется в форме капель в цитоплазме. В большинстве других органов ЭХС составляет меньшую часть всего ХС. Например, в нервной ткани, где сосредоточено 20-25% всего ХС, почти 100% приходится на НЭХС.
С возрастом в плазме крови, в соединительной ткани, жировой ткани, коже, интиме артерий происходит увеличение содержания ХС, преимущественно за счет ЭХС.
Фонд ХС организма создается за счет ХС пищи и его синтеза в самом организме. При питании растительной пищей, в которой ХС мало, главное значение имеет синтез ХС.
Биосинтез холестерола
В принципе синтез ХС осуществляется в клетках почти всех органов и тканей, однако в значительных количествах – в печени (80%), стенке тонкой кишки (10%) и коже (5%).
Биосинтез ХС можно разделить на 3 стадии: 1 – биосинтез мевалоновой кислоты; 2 – образование сквалена из мевалоновой кислоты; 3 – циклизация сквалена и образование ХС.
Образование мевалоновой кислоты
Молекула мевалоновой кислоты в печени образуется из ацетильных остатков ацетил-КоА.

Общее количество ХС, синтезируемого в организме человека за сутки, достигает 500 мг.
Регуляция синтеза ХС
Скорость синтеза ХС регулируется по механизму отрицательной обратной связи. Основным пунктом регуляции является реакция образования мевлоновой кислоты – первая специфическая реакция пути синтеза ХС: ХС ингибирует ГМГ-КоА-редуктазу и подавляет ее синтез. При содержании 2-3 г ХС в суточной пище человека синтез собственного ХС почти полностью прекращается.
|
|
|
Транспорт холестерола
Как было указано выше, ХС синтезируется в клетках печени, кишечника и кожи. Другие органы и ткани получают его с кровью, поглощая ЛПНП путем эндоцитоза. Предотвращение избыточного накопления ХС в клетках обеспечивают ЛПВП. ЛПВП выступают в роли “уборщиков” свободного холестерола с поверхности клеток. Поступая в ЛПВП холестерол этерифицируется под действием ЛХАТ:

Образовавшиеся эфиры холестерола погружаются внутрь частицы. Вследствие этого концентрация холестерола в поверхностном слое уменьшается и освобождается место для поступления холестерола из других клеток. Т.о. гомеостаз холестерола в клетках разных органов поддерживается путем обмена холестерола между клетками и липопротеинами.
Биосинтез желчных кислот
В печени часть холестерола превращается в желчные кислоты. В гепатоцитах из холестерола образуются хенодезоксихолевая и холевая кислоты – первичные желчные кислоты. Их образование включает реакции введения гидроксильных групп при участии гидролаз и реакции частичного окисления боковой цепи ХС.
После выведения желчи в кишечник под действием ферментов кишечной флоры из первичных желчных кислот образуются вторичные желчные кислоты – литохолевая и дезоксихолевая кислоты. Они всасываются из кишечника, с кровью воротной вены попадают в печень, а затем в желчь.
В желчи содержатся в основном конъюгированные желчные кислоты, т.е. их комплексы с глицином или таурином. Боковая цепь с остатком глицина или таурина гидрофильна, в то время как другой конец молекулы (циклическая группировка) гидрофобна. Амфифильная природа желчных кислот обусловливает их поверхностно-активные свойства и участие в переваривании жиров.
Концентрация желчных кислот в желчи равна примерно 1%. В желчи содержатся также фосфолипиды (фосфатидилхолины, 0,5%), холестерин (0,5%), а также билирубин и минеральные соли. Следует отметить, что концентрация отдельных компонентов желчи непостоянна.
Энтерогепатическая циркуляция и экскреция желчных кислот и холестерина
Основная часть желчных кислот (90-95%) всасывается из полости кишечника, с кровью воротной вены попадает в печень и повторно используется при образовании желчи. Желчные кислоты проходят кишечнопеченочный круг 5-10 раз в сутки.
Небольшая часть желчных кислот (~0,5 г/сутки) выводится с калом. Эта убыль компенсируется синтезом в печени новых желчных кислот в таком же количестве. Фонд желчных кислот обновляется полностью примерно за 10 дней.
Фонд холестерина в организме пополняется двумя путями: синтезом холестерина в тканях (~1,0 г/сутки) и поступлением из кишечника. Удаление холестерина из организма происходит тоже двумя путями: путем превращения в желчные кислоты с последующей экскрецией желчных кислот с калом (~0,5 г/сутки) и путем экскреции неизмененного холестерина и выведения его с калом. Эти механизмы обеспечивают поддержание концентрации холестерина в организме на постоянном уровне. Если нарушен баланс между поступлением холестерина из кишечника и его синтезом в организме, с одной стороны, и выведением желчных кислот и холестерина – с другой, то концентрация холестерина в тканях и в крови изменяется. Наиболее серьезные последствия связаны с повышением концентрации холестерина в крови – гиперхолестеринемией. При этом возрастает вероятность заболевания атеросклерозом и желчно-каменной болезнью.
Гиперлипопротеинемии
ЛП в крови имеются постоянно, но их концентрация меняется в зависимости от ритма питания. После приема пищи концентрация ЛП повышается, достигая максимума через 4-5 часов, а затем вновь снижается. За нормальное принимают содержание ЛП у здоровых людей через 10-12 часов после еды; кровь для анализа берут утром после ночного голодания. В этом состоянии в крови здоровых людей отсутствуют ХМ и обнаруживаются только ЛПОНП (~15% от всех ЛП), ЛПНП (60%) и ЛПВП (25%).
Практически весь ХС и все жиры плазмы крови находятся в составе ЛП. В норме содержание общего ХС, т.е. суммы свободного и этерифицированного ХС в крови равно 150-280 мг/дл. При этом на долю эфиров ХС приходится 65-75% общего ХС. Содержание ТАГ в сыворотке крови в норме составляет менее 165 мг/дл. При повышенном содержании ЛП в крови (гиперлипопротеинемия) может быть повышено либо содержание ХС, либо содержание ТАГ, либо ХС и ТАГ одновременно. В связи с этим различают три формы гиперхолестеринемии (ГЛП):
1) гиперхолестеринемия (повышена концентрация ЛПНП и ЛПВП)
2) гипертриацилглицеринемия (повышена концентрация ХМ или ЛПОНП)
3) смешанная форма
ГЛП – очень распространенные нарушения обмена: они обнаруживаются ~ у каждого десятого человека.
По механизму возникновения ГЛП делят на наследственные (первичные) и приобретенные (вторичные).
Примером наследственной ГЛП может быть гиперхиломикронемия (ГХМ). При этом заболевании имеется врожденный дефект ЛПЛ – ее активность в несколько раз ниже, чем у здоровых людей, либо дефицит апо С-II, вследствие чего ЛПЛ, присутствуя в нормальном количестве, не может гидролизовать ХМ и ЛПОНП. В результате резко повышается концентрация ТАГ в крови, их содержание в 10-40 раз превышает норму. В то же самое время содержание ХС лишь несколько превышает норму. Частым осложнением гиперхиломикронемии является панкреатит, который служит основной причиной смертности при этой болезни.
Другой пример ГЛП – семейная гиперхолестеринемия (СГХС). Эта форма встречается значительно чаще – у 0,2% населения земного шара. Заболевание связано с наследованием дефектных генов, кодирующих рецептор ЛПНП. Поскольку рецептор-зависимый эндоцитоз играет основную роль в катаболизме ЛПНП, заболевание проявляется повышением в крови концентрации ЛПНП, а также ХС, поскольку его много в ЛПНП. Поэтому для СГХС характерно отложение ХС в тканях, в частности в коже (ксантомы), в стенках артерий. Отложение ХС в коронарных артериях является причиной высокой частоты ИБС и инфаркта миокарда, который у гомозигот может быть в очень раннем возрасте, даже в 10 лет.
Вторичные ГЛП являются следствием таких заболеваний как сахарный диабет, гипертиреоз, гепатиты, нефрозы, прием пероральных противозачаточных препаратов.
Атеросклероз
ГЛП, сопровождающаяся гиперхолестеринемией, повышают риск развития атеросклероза. Вероятность развития атеросклероза тем выше, чем больше отношение концентраций ЛПНП и ЛПВП в крови.
Главное биохимическое проявление атеросклероза – отложение холестерина в стенках артерий. В 1915 году русский ученый Аничков постулировал, что без холестерина не может быть атеросклероза. В экспериментах на кроликах, содержащихся на диете с высоким содержанием холестерина, он наблюдал развитие у них атеросклероза. Холестериновая концепция атеросклероза лежит в основе и современных взглядов на патогенез атеросклероза.
Атеросклеротические изменения начинаются с появления липидных пятен или полосок на внутренней поверхности артерий. В аорте эти пятна и полоски впервые появляются еще в детском возрасте, примерно с трех лет. Затем на месте пятен и полосок появляются утолщения – фиброзные бляшки. При разрезании такой бляшки из нее выдавливается желтая кашица, состоящая в основном из эфиров холестерола. Бляшки могут изъязвляться. При этом изъязвленная поверхность служит местом образования пристеночных тромбов. Язвы зарастают соединительной тканью. В образующийся рубец откладываются соли кальция, что приводит деформации стенки сосуда и сужению просвета сосуда вплоть до его полной закупорки.
Наиболее частыми и опасными осложнениями атеросклероза являются стенокардия, инфаркт миокарда, инсульт, облитерирующий эндартериит, почечная гипертония вследствие стеноза почечной артерии.
Исследованиями последних лет показано, что гиперхолестеринемия является следствием образования в сосудистом русле модифицированных ЛПНП вследствие перекисного окисления, гликозилирования, ограниченного протеолиза и других процессов, происходящих в белковом или липидном компонентах частиц ЛПНП. Результатом этого является нарушение естественного катаболизма ЛПНП вследствие снижения их сродства к рецепторам ЛПНП и повышение уровня таких липопротеинов в крови. Модифицированные ЛПНП поступают в стенку артерий путем пассивной диффузии, где захватываются моноцитами-макрофагами (благодаря наличию у последних Скэвенджер-рецепторов). Ферментный набор макрофагов не способен катализировать какие-либо превращения ХС, кроме его этерификации. Поэтому ХС накапливается в клетках в больших количествах. Капли эфиров ХС в цитоплазме придают макрофагам характерный пенистый вид. Подавляющая часть пенистых клеток гибнет, при этом ХС выделяется в межклеточное пространство. Образуются очаговые скопления ХС и создается угроза развития сначала липидных пятен, а затем атеросклеротических бляшек.
Между отложениями холестерина в артериях и ЛП крови происходит двусторонний обмен ХС, но при гиперхолестеринемии преобладает поток ХС в стенки артерий. Методы профилактики и лечения атеросклероза направлены на то, чтобы усилить обратный поток, обычно путем уменьшения гиперхолестеринемии. Для этого применяют малохолестериновую диету, лекарства, увеличивающие экскрецию ХС или ингибирующие его синтез. В особо тяжелых случаях снижение ХС в плазме крови достигается с помощью процедуры, получившей название плазмоферез. При плазмоферезе у больного забирают относительно большой объем крови, возвращают обратно форменные элементы, а вместо собственной плазмы вводят донорскую с низкой концентрацией ХС или раствор человеческого альбумина.
Вероятность развития атеросклероза рассчитывается по формулам, учитывающим отношение атерогенных и антиатерогенных фракций ЛП. Наиболее известен холестериновый коэффициент атерогенности, предложенный акад. РАМН Климовым (1977 г.):

У здоровых лиц КХС не превышает 3-3,5. У больных ИБС величина коэффициента нередко достигает 5-6 и более единиц.
Желчно-каменная болезнь
При желчно-каменной болезни в желчном пузыре или протоках образуются камни в результате кристаллизации и осаждения компонентов желчи. Различают два типа желчных камней: преимущественно холестериновые, которые содержат больше 70% ХС, и преимущественно билирубиновые. Чаще, примерно в 2/3 случаев встречаются холестериновые камни.
ХС в желчи может существовать в трех фазах. Первая – это смешанные мицеллы, содержащие ХС, желчные кислоты и фосфатидилхолин. Вторая фаза – внемицеллярный жидкокристаллический ХС в водном окружении желчи. Жидкокристаллическая фаза нестабильна: ХС стремится перейти из нее в мицеллы, либо в третью фазу. Третья фаза – твердокристаллический ХС, выпадающий в осадок.
Увеличение синтеза ХС или уменьшение синтеза желчных кислот может привести к относительному избытку ХС, т.е. такому состоянию, когда мицеллы не способны вместить весь ХС желчи – желчь становится насыщенной ХС. Осаждению ХС и образованию холестериновых камней способствуют застой желчи, воспалительные заболевания желчного пузыря и протоков. Образовавшиеся камни могут вызывать спазмы желчного пузыря и протоков, которые сопровождаются приступами боли.
До настоящего времени основным способом лечения желчно-каменной болезни остается хирургическое удаление камней. Однако сейчас начинают применять и другой метод лечения – введение хенодезоксихолевой кислоты: от этой желчной кислоты в наибольшей степени зависит растворимость ХС. Кроме того хенодезоксихолевая кислота ингибирует гидроксиметилглутарил-КоА-редуктазу. При приеме 1 г хенодезоксихолевой кислоты в день синтез ХС снижается вдвое, его концентрация в желчи снижается, а концентрация желчных кислот напротив возрастает. Это приводит не только к прекращению осаждения ХС, но и растворению уже имеющихся холестериновых камней. Камни размером с горошину растворяются ~ в течение полугода.
|
|
|


