 |
Основные положения молекулярной физики.
|
|
|
|
Термодинамика
Лекция 1.
Термодинамика изучает процессы, происходящие в системах с точки зрения превращения и изменения энергии.
Например, рассмотрим абсолютно неупругий удар двух шаров.
Мы знаем, что после удара тела движутся с одинаковыми скоростями.
Если массы шаров –  , а их скорости были –
, а их скорости были –  и направлены навстречу друг другу, то согласно закону сохранения импульса после центрального удара скорости шаров станут равны
и направлены навстречу друг другу, то согласно закону сохранения импульса после центрального удара скорости шаров станут равны
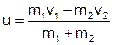 .
.
Используя законы механики, мы находим скорости шаров. Но представим себе, что импульсы шаров равны по модулю. Движение прекращается. Что произошло с энергией? Она стала равной нулю?
Конечно, нет. Да, механическая энергия становится равной нулю. Но, согласно первому началу термодинамики за счет механической работы увеличилась внутренняя энергия шаров. Механическая энергия переходит во внутреннюю. Шары нагреваются.
Следовательно, термодинамика объясняет процессы более широко, чем это делается в механике. Основным законом, который используется при рассмотрении процессов, является закон сохранения энергии: энергия не исчезает и не появляется вновь, она только переходит из одного вида в другой.
Еще не нашлось ни одного случая, эксперимента, в котором было бы замечено нарушение закона сохранения энергии.
Все теплотехнические расчеты, которые мы будем в дальнейшем делать основаны на этом законе.
Как и в любой области физики для формулировки законов в термодинамике вводятся физические понятия.
Данное определение термодинамики требует уточнения понятия «система».
Под системой мы предполагаем некоторую часть заполненного пространства, отделяемую от окружающего мира определенной границей.
|
|
|
При этом термодинамические системы взаимодействуют с окружающей средой.
По типу взаимодействия системы делятся на изолированные (замкнутые) – нет обмена ни энергией, ни веществом; закрытые – нет обмена веществом, но есть обмен энергией, например, нагревание или охлаждение, открытые системы – обмен и энергией и веществом.
Основные положения молекулярной физики.
«Если бы в результате какой-то мировой катастрофы все накопленные научные знания оказались бы уничтоженными, и к грядущим поколениям живых существ перешла бы только одна фраза, то, какое бы утверждение, составленное из наименьшего числа слов, принесло бы наибольшую информацию? Я считаю, что это атомная гипотеза: все тела состоят из атомов – маленьких телец, которые находятся в беспрерывном движении, притягиваются на небольшом расстоянии, но отталкиваются, если одно из них плотнее прижать к другому. В одной этой фразе, как вы убедитесь, содержится невероятное количество информации о мире, стоит приложить к ней немного воображения и чуть соображения» (Р. Фейнман).
Вспомним молекулярно-кинетическую теорию, которая рассматривает процессы, проходящие в системе, на основе представлений о молекулярном строении вещества.
Перечислим основные положения молекулярно-кинетической теории.
1) Все тела состоят из молекул; размеры молекул малы, в пределах от 10-10 до 10-5 м, так размер молекул водорода 2,3 × 10-10 м, а молекул белка порядка 10-5 м. Хотя размеры молекул малы, но число их огромно. Например, в наперстке воды содержится приблизительно 1023 молекул.
2) Молекулы находятся в непрерывном хаотическом движении;
Для различных агрегатных состояний характер движения молекул различен:
· в твердых телах молекулы колеблются вблизи положений равновесия, твердые тела сохраняют форму и объем,
· в жидкостях молекулы колеблются почти так же, как и в твердых телах, но сами положения равновесия постоянно перемещаются (молекулы жидкости – это “кочевники”), жидкости принимают форму сосуда и слабо сжимаемы.
|
|
|
· в газах молекулы свободно и хаотически (беспорядочно) движутся, газ занимает весь предоставленный ему объем, легко сжимается.
3) средняя скорость теплового движения молекул пропорциональна корню квадратному из абсолютной температуры; при комнатной температуре средние скорости молекул составляют сотни метров в секунду.
4) Молекулы взаимодействуют друг с другом, между ними действуют силы притяжения и силы отталкивания.
На графиках показана зависимость силы взаимодействия и потенциальной энергии взаимодействия молекул в зависимости от расстояния между ними.

Силы взаимодействия определяют агрегатное состояние вещества.
Наибольшее значение сил взаимодействия молекул, атомов и ионов твердого тела,

Опыты и наблюдения, подтверждающие эту теорию – это явления теплопроводности, диффузии и внутреннего трения, то есть явления переноса, а также броуновское движение, которое служит наглядным доказательством молекулярного строения вещества.

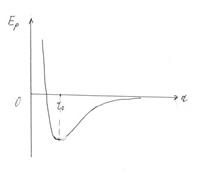
На рисунках показаны структуры аморфных и кристаллических тел.

Аморфная структура кварца


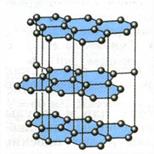

Атомные кристаллические решетки слюды и алмаза. В узлах кристаллических решеток атомы углерода.
Так как силы взаимодействия молекул газа малы, то часто можно ими пренебречь, что упрощает рассмотрение и объяснение физических явлений.
Свойства газов
Газ характеризуется тремя макропараметрами: объемом V, давлением р и температурой T.
Температура
Понятие температуры является одним из важнейших понятий в молекулярной физике и термодинамике. Температура определяет направление теплового потока.
Максвеллом дано такое определение температуры: «температура тела есть его термическое состояние, рассматриваемое с точки зрения его способности сообщать тепло другим телам».
Измерение температуры должно быть связано с монотонным изменением какого-то параметра. Например, мы знаем, что давление идеального газа при постоянном объеме увеличивается при нагревании по линейному закону, также объем при постоянном давлении линейно зависит от температуры, вот уже два рецепта измерения температуры.
|
|
|
Эмпирическая шкала Цельсия определяется следующим образом. Берется объем при температуре таяния льда и объем при температуре кипения воды при атмосферном давлении. При этом термометр находится в состоянии теплового равновесия с тающим льдом и соответственно с кипящей водой.
Таким образом, устанавливаются две точки шкал 0° и 100°. Разделив отрезок между этими точками на 100 отрезков, мы получаем температурную шкалу для измерения температуры.
Каждый маленький отрезок соответствует градусу. Измерение температуры сводится к измерению длины столбика жидкости.
Эта шкала не универсальна, так как расширение при нагревании и охлаждении зависит от рабочего вещества – спирт, ртуть и т.д.
Согласно закону Шарля, если объем газа постоянен, то при изменении температуры на 1° С давление изменяется приблизительно на 1/273 его первоначального давления при 0°С. При температуре, равной – 273,15 °С давление равно нулю. Это абсолютный ноль температур.
Температурная шкала, ведущая отсчет от абсолютного нуля, называется абсолютной температурной шкалой или шкалой Кельвина.
Связь температур по шкале Цельсия и Кельвина имеет вид:
Т = t°С + 273,15°С.
Отсюда следует, что значения температуры по этим шкалам различны, однако числовые значения изменения температуры одинаковы.
Кроме этих шкал используется шкала Фаренгейта.
Связь со шкалой Цельсия шкалы Фаренгейта следующая: t°С =  .
.
T = t ° C + 273° C
Равновесное состояние – это состояние, при котором температура и давление во всех точках объема одинаковы.
Уравнение состояния идеального газа
рV = 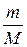 RT – уравнение Клапейрона-Менделеева.
RT – уравнение Клапейрона-Менделеева.
Универсальная газовая постоянная связана с числом Авогадро NA и постоянной Больцмана k соотношением:
R = kNA,
где k = 1,38 × 10-23  .
.
рV = NkT,
 , где
, где  плотность газа.
плотность газа.
Если в сосуде объемом V находится смесь газов, то давление смеси определяется законом Дальтона:
Давление смеси газов равно сумме парциальных давлений: р = р 1 + р 2 + …
Парциальное давление рi – давление компоненты смеси, если бы она занимала весь объем, т.е.
|
|
|
рi =  ,
,
где m i и M i – масса и молярная масса i -ой компоненты смеси соответственно. Таким образом, если в сосуде находится смесь n различных газов, то
р =  =
=  .
.
Так как  = r I – плотность i -ой компоненты,
= r I – плотность i -ой компоненты,
р = RT 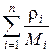 .
.
Газовые законы
Газовые законы справедливы для идеального газа, т.е. газа, в котором можно пренебречь силами взаимодействия молекул и размерами молекул.
Можно сказать, что газ идеальный, если он подчиняется газовым законам.
Одним из первых газовых законов был закон, определяющий связь между давлением и объемом при постоянной температуре, открытый Р.Бойлем (1627-1691). Этот закон называют законом Бойля-Мариотта, т.к. он независимо был открыт Э.Мариоттом (1620-1727).
Процесс называется изотермическим, если он происходит при постоянной температуре.
Закон Бойля-Мариотта: для данной массы газа при постоянной температуре произведение давления газа на объем – величина постоянная.

На рис. изображены изотермы на p-V диаграмме.

Процесс называется изохорным, если он происходит при постоянном объеме.
Закон Ж. Гей-Люссака(1778-1850): для газа данной массы при постоянном давлении объем изменяется с температурой по закону:
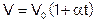 , (1)
, (1)
где  – объем газа при температуре 0°С, α = 1/273°С.
– объем газа при температуре 0°С, α = 1/273°С.
Абсолютная температура рана Т = t + 273°С.
Из уравнения (1) следует,  .
.
Отсюда следует, что  .
.
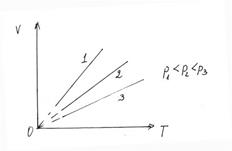
Закон Ж. Шарля (1746-1823): для газа данной массы при постоянном объеме давление изменяется с температурой по закону:
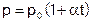 , (1)
, (1)
где 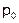 – объем газа при температуре 0°С, α = 1/273°С.
– объем газа при температуре 0°С, α = 1/273°С.
Абсолютная температура рана Т = t + 273°С.
Из уравнения (1) следует,  .
.
Отсюда следует, что 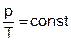 .
.

Любой газовый закон – частый случай уравнения Менделеева-Клапейрона.
В то же время уравнение состояния идеального газа найдено на основе газовых законов
– уравнение Клапейрона:
 при постоянной массе газа.
при постоянной массе газа.
Согласно закону Авогадро один моль газа при нормальных условиях занимает объем  = 22,4 л.
= 22,4 л.
Нормальные условия  ,
,  .
.
Тогда для одного моля имеем  .
.
Эта постоянная называется универсальной газовой постоянной, так как ее значение не зависит от вида газа.
Авогадро высказал также предположение, что при одной и той же температуре и одном и том же давлении разные объемы газов содержат одинаковое число молекул.
Из этого следовало, что, при постоянных давлении и температуре, объем газа пропорционален числу молей.
Очевидно, что 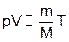 . Так как из (8) следует, что
. Так как из (8) следует, что 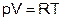 для одного моля, то можно записать уравнение состояния идеального газа, называемое уравнением Менделеева-Клапейрона:
для одного моля, то можно записать уравнение состояния идеального газа, называемое уравнением Менделеева-Клапейрона:
 .
.
Универсальная газовая постоянная равна произведению постоянной Больцмана на число Авогадро:  .
.
|
|
|
Число молекул определяется произведением числа молей на число Авогадро - 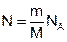 .
.
Тогда  , соответственно, разделив левую и правую части этого равенства на объем, получим
, соответственно, разделив левую и правую части этого равенства на объем, получим
 (9)
(9)
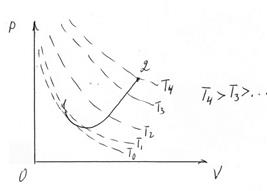
Рассмотрим, как по диаграмме можно судить об изменениях параметров газа в результате произвольного процесса.
На рис. Показан процесс перехода из состояния 1 в состояние 2.
Нарисовав серию изотерм, мы сразу можем сказать, что в результате этого процесса температура газа увеличилась.
|
|
|


