 |
Идентификация катионов металлов на стилоскопе
|
|
|
|
Сущность метода. Между двумя графитовыми электродами, в углублении одного из которых находится определяемое вещество, зажигается электрическая дуга или искра (I). Излучение направляется трехлинзовым осветителем (2) на щель прибора (З). Наблюдатель рассматривает в окуляр (4) спектр анализируемого вещества.
Блок-схема стилоскопа:

Выполнение работы: Сначала следует ознакомиться со спектрами изучаемых элементов.
Спектральные линии для определения элементов
| Элемент | Цвет линии | Длина волны, нм |
| Ag | зеленый | 520,9 |
| ярко-зеленый | 546,5 | |
| Са | группа зеленых линий | 527,0 |
| 526,6 | ||
| 525,4 | ||
| 526,20 | ||
| 526,17 | ||
| К | фиолетовый | 766,5 |
| 404,7 | ||
| 404,4 | ||
| Mg | синий | 518,4 |
| 517,3 | ||
| Nа | две желтые линии | 589,0 |
| 589,6 |
Для этого внимательно просматривают их спектры излучения в дуговом режиме. С этой целью наполняют угольный электрод с цилиндрическим углублением какой либо солью элемента. Заполненный электрод ставят в нижний электрододержатель. Верхний - на столик стилоскопа над нижним электродом, включают в ток (при этом переключатель должен быть установлен в положении «дуга») и наблюдают спектры излучения по всей области спектра, наводя стрелку окуляра на все интенсивные линии данного элемента. После изучения спектров приступают к определению элементов в предложенных образцах.
Ионы K+
2K+ + Na+ + [Co(NO2)6]3- → K2Na[Co(NO2)6]↓ – желтый осадок
Мешают ионы аммония, устранить их мешающее действие можно отгонкой солей аммония NH4Cl  NH3↑ + HCl
NH3↑ + HCl
Ионы Ca2+
Ca2+ + SO42– + 2H2O → CaSO4·2H2O – гипс, микрокристаллоскопическая реакция (звездочки).
Ионы Ag+
Ag+ + Cl– → AgCl↓ – белый осадок
AgCl↓ + HCl → HAgCl2, избыток осадителя вреден
AgCl↓ + 2NH3 → [Ag(NH3)2]Cl
[Ag(NH3)2]Cl + KI → AgI↓ + 2NH3 + KCl – желтый осадок
|
|
|
Ионы Fe2+
3Fe2+ + 2[Fe(CN)6]3– → Fe3[Fe(CN)6]2↓ – турнбулева синь, осадок
красная кровяная соль
Ионы Fe3+
4Fe3+ + 3[Fe(CN)6]4- → Fe4[Fe(CN)6]3↓ берлинская лазурь, осадок
желтая кровяная соль
В действительности выпадающий синий осадок имеет один и тот же состав с плавающим зарядом:
KFe[Fe(CN)6]
III II
II III
Fe3+ + 4SCN– → [Fe(SCN)4]–, раствор окрашен в кроваво-красный цвет; реакция используется при фотометрическом определении железа(III).
Ионы Cu2+
Cu2+ + 4NH3 → [Cu(NH3)4]2+, сине-фиолетовое окрашивание раствора; сходный по цвету аммиакат дает Ni2+
Cu2+ + Fe → Cu↓ + Fe2+ – красный осадок металлической меди
Ионы Ni2+
[Ni(NH3)6]2+ + 2H2Dm → Ni(HDm)2↓ + 2NH4+ + 4NH3

комплекс никеля(II) с диметилглиоксимом
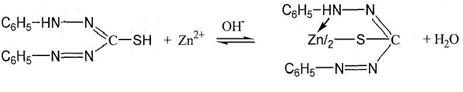
Ионы Zn2+
Реакция образования комплексного соединения цинка с дитизоном:
Ионы Al3+
При взаимодействии ионов алюминия с ализарином образуется комплекс:

Ионы Co2+
Co2+ + 4SCN–  [Co(SCN)4]2–, – синее окрашивание раствора; необходимо маскирование железа(3+)
[Co(SCN)4]2–, – синее окрашивание раствора; необходимо маскирование железа(3+)
Ионы Cr(3+)
2[Cr(OH)4]– + 2OH– + 3H2O2 → 2CrO42– + 8H2O – желтое окрашивание
Ионы Mn2+ идентифицируют окислением их с помощью PbO2, (NH4)2S2O8, NaBiO3. Реакции мешают хлорид-ионы:
2MnO4– + 16H+ + 10Cl– → 2Mn2+ + 8H2O + 5Cl2↑
Окисление персульфатом аммония проводят в присутствии катализатора – солей серебра:
2Ag+ + S2O82– → 2Ag2+ + 2SO42–
Далее ионы Ag2+ окисляют ионыMn2+, а сами восстанавливаются:
Mn2+ + 5Ag2+ + 4H2O → MnO4– + 5Ag+ + 8H+
Суммарно:
2Mn2+ + 5S2O82– + 8H2O → 2MnO4– + 10SO42– + 16H+
Реакция окисления висмутатом натрия:
2Mn2+ + 5BiO3– + 14H+ → 2MnO4– + 5 Bi3+ + 5Na+ + 7H2O
Для проведения берут одну каплю(!) исследуемого раствора, чтобы не протекала реакция диспропорционирования Mn2+ → MnO2↓ ← MnO4–.
Ионы Bi3+ обнаруживают по протеканию реакции гидролиза:
Bi3+ + Cl– + H2O → BiOCl↓ + 2H+ – белый осадок
Реакция с тиомочевиной:
Bi3+ + 3(NH2)2CS → [Bi(SC(NH2)2)3]3+ – желтый комплекс
Ионы CO32–, HCO3–
CO32– + 2H+ → H2CO3 (H2O + CO2↑) – выделение углекислого газа
|
|
|
Ca(OH)2 + CO2 → CaCO3↓ + H2O – помутнение известковой воды
Ионы H2PO4–, HPO42-, PO43- реакция с модибденовой жидкостью
PO43– + 3NH4+ + 12MoO42– + 24H+ → (NH4)3[PMo12O40]↓ + 12 H2O
желтый осадок фосфоромолибдата аммония
Еще один метод идентификации c магнезиальной смесью:
Mg2+ + HPO42– + NH4OH → MgNH4PO4↓ + H2O – осадок белого цвета
Ионы SO42–
SO42– + Ba2+ → BaSO4↓ – белый кристаллический осадок, не растворим в HCl, HNO3
Ионы Cl–
Cl– + Ag+ → AgCl↓ – белый творожистый осадок, растворимый в аммиаке
AgCl↓ + 2NH3 → [Ag(NH3)2]+ + Cl–
Подкисление [Ag(NH3)2]+ + Сl– + 2H+ → AgCl↓ + 2NH4+
Хлор активный
Cl2 + 2KI → 2KCl + I2
– синее окрашивание с крахмалом и фиолетовое в вазелиновом масле
Ионы NO3– обнаруживают с дифениламином по появлению синего окрашивания


Идентификацию и количественное определение можно также проводить с помощью ион-селективного электрода:
Е = Е° – 0,059 lg a(NO3–)
Ионы СН3СОО–
СН3СООNa + H2SO4 → 2CH3COOH + Na2SO4 – запах уксуса
При добавлении этилового спирта образуется летучий эфир с характерным запахом (этилацетат).
Для определения ацетат-ионов можно использовать реакцию с хлоридом железа(III):
FeCl3 + 3CH3COONa → Fe(CH3COO)3 + NaCl
3Fe(CH3COO)3 + 2H2O → [Fe3(CH3COO)6(OH)2]CH3COO + 2CH3COOH,
выпадает красно-бурый осадок комплексного соединения при нагревании раствора.
ЛИТЕРАТУРА
1. Пилипенко А.Т., Пятницкий И.В. Аналитическая химия. В 2-х книгах. – М.: Химия, 1990. – Кн. 2. – С. 537-562.
2. Пономарев В.Д. Аналитическая химия. В 2-х частях. – М.: Высшая школа, 1982. – Ч. 1. – С. 149-168, 189-193, 202-206, 224-238, 240-250, 252-271.
3. Харитонов Ю.Я. Аналитическая химия. Аналитика. В 2-х книгах. – М.: Высшая школа, 2001. – Кн. 1. – С. 288-301, 320-592.
4. Алексеев В.Н. Курс качественного химического полумикроанализа. – М.: Химия, 1973. – С.13-32, 121-147, 187-205, 316-371, 409-419, 444-452.
5. Крешков А.П. Основы аналитической химии. Т. 1. – М.: Химия, 1970. – С.145-147, 180-181, 200-201, 246-247, 302-305, 327, 339-341, 342-344, 345-385, 386–428.
|
|
|


