 |
Методика выполнения работы
|
|
|
|
Цели работы:
1. Изучить зависимость давления насыщенного пара легколетучего жидкого вещества от температуры.
2. Вычислить теплоту парообразования легколетучего вещества на основании опытных данных графическим и аналитическим способом.
3. Рассчитать изменение энтропии в процессе испарения исследуемой жидкости.
Теоретическая часть
Второе начало термодинамики позволяет определить, в каком направлении будет в действительности протекать процесс, когда и при каких условиях установится состояние равновесия между паром и жидкостью, и как температура и давление влияют на это состояние равновесия.
Математическое выражение второго закона термодинамики имеет вид:
· для обратимых процессов  (1)
(1)
· для необратимых процессов  (2)
(2)
где S – некоторая функция состояния, введённая Клаузиусом и названная энтропией.
Энтропия – величина экстенсивная, т.е. зависящая от количества вещества в системе.
Энтропия является функцией состояния, и её изменение не зависит от пути процесса, а определяется начальным и конечным состоянием системы.
Изменение энтропии:  (3)
(3)
где S1 и S2 – энтропии соответственно начального и конечного состояний.
Для изотермического процесса:  (4)
(4)
Для изобарного процесса:  (5)
(5)
где  – теплота фазового перехода,
– теплота фазового перехода,  – абсолютная температура фазового перехода.
– абсолютная температура фазового перехода.
Основной закон фазового равновесия – переход веществ из одной фазы в другую.
Правило фаз Гиббса: число степеней свободы равновесной термодинамической системы равно числу независимых компонентов системы минус число фаз плюс число внешних факторов, влияющих на равновесие в данной системе.
С=К–Ф+n (6)
Если на равновесие в системе влияют только температура и давление, то в уравнении (6) число внешних факторов n будет равно двум:
|
|
|
С=К–Ф+2.

Уравнение Клаузиуса – Клапейрона для процесса парообразования.
При равновесии между двумя фазами должно выполняться условие:
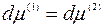 (7)
(7)
Для обратимых процессов можно написать выражения для химического потенциала одного моля чистого вещества в первой и второй фазах:
 (8)
(8)
Подставим уравнения (8) в условие равновесия (7):

Преобразуем полученное выражение:
 (9)
(9)
Для обратимых изотермических переходов 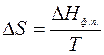 , где
, где 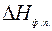 – теплота фазового перехода; T – температура фазового перехода. Подставляя значение
– теплота фазового перехода; T – температура фазового перехода. Подставляя значение 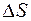 в уравнение (9),получаем выражение:
в уравнение (9),получаем выражение:
 ,..(10)
,..(10)
которое называется уравнением Клаузиуса – Клапейрона и используется для описания термодинамики равновесных фазовых переходов.
Теплота парообразования 
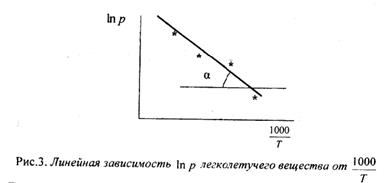
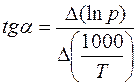
Уравнение Клаузиуса – Клапейрона в интегральном виде:
 или
или 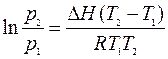
Уравнение Кирхгофа: 

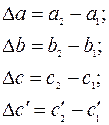
· для органических веществ:  ;
;
· для неорганических веществ:  .
.
При атмосферном давлении 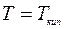
 .
.
Экспериментальная часть
Схема установки для определения давления насыщенного пара легколетучей жидкости и её температуры кипения представлена на рис.4.

1 – сосуд;
2 – обратный холодильник;
3 – термометр;
4 – стакан с водой;
5 – вакуумметр;
6 – насос Комовского;
7 – кран;
8 – электроплитка.
Методика выполнения работы
В открытом сосуде жидкость закипает, когда давление насыщенного пара становится равным атмосферному давлению. Если откачать частично воздух из закрытого сосуда, содержащего жидкость, то наблюдается понижение температуры кипения до такого уровня, при котором давление насыщенного пара равно давлению воздуха внутри прибора.
1. Перед началом работы необходимо проверить наличие жидкости и капилляров в сосуде 1. Включить электроплитку, поставить на неё стакан с водой для нагревания.
2. Первым этапом работы является проверка герметичности системы. Для этого кран 7 ставят в такое положение, при котором установка сообщается с насосом Комовского.
|
|
|
3. При помощи насоса в системе создают максимальное разрежение, чтобы стрелка вакуумметра занимала положение в пределах от 0,9 до 1,0.
4. После этого кран 7 закрывают и тем самым изолируют систему от насоса и внешней среды. Если в течение 5 – 10 минут стрелка вакуумметра не изменит своего положения, то считают, что герметичность системы обеспечена.
5. На втором этапе работы задают разрежение в системе такое, чтобы вакуумметр показывал значение в пределах от 0,95 до 1,0. К этому моменту времени вода в стакане должна нагреться. В стакан с нагретой водой опускают сосуд 1 с исследуемой жидкостью.
6. Как только жидкость в сосуде закипит, отмечают температуру кипения и показания вакуумметра. Отсчёты температуры кипения и показания вакуумметра должны относиться к одному и тому же времени. Затем сосуд 1 поднимают из стакана с водой для того, чтобы прекратить кипение и испарение исследуемой жидкости из сосуда.
7. После первого определения температуры кипения жидкости давление в системе увеличивают примерно на 0,1 деления вакуумметра путём осторожного перевода крана 7 на короткий промежуток времени в положение, при котором в систему попадает воздух. Другим способом является создание нового давления с помощью насоса Комовского после полного открытия крана 7.
8. При новом давлении (кран 7 закрыт после установления нужного давления) определяют температуру кипения так же, как и в первом опыте.
Таким образом, измерения повторяют до тех пор, пока давление в сосуде не достигнет атмосферного (положение стрелки вакуумметра на 0). Необходимо провести 8-10 таких измерений при разных значениях 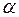 (от 0,95 до 0).
(от 0,95 до 0).
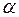 – показания стрелки вакуумметра;
– показания стрелки вакуумметра;
рс – давление насыщенного пара исследуемой жидкости при данной температуре;
рб – барометрическое (внешнее атмосферное) давление, которое определяют по барометру в препараторской комнате.
|
|
|


