 |
Первый закон термодинамики
|
|
|
|
Лекция № 1. Основы химической термодинамики
План
1. Основные понятия и определения химической термодинамики.
2. Первое начало термодинамики.
3. Законы термохимии.
4. Направление самопроизвольного протекания процессов. Второе начало термодинамики.
5. Особенности термодинамики биологических систем.
Химическая термодинамика изучает энергетические явления при химических процессах и устанавливает направление и пределы протекания процессов при заданных условиях.
Основные понятия и определения химической термодинамики.
Объектом изучения в химической термодинамике является система.
Система – это вещество или смесь веществ, мысленно или фактически выделенные из окружающей среды.
По характеру взаимодействия с окружающей средой различают открытые, закрытые и изолированные системы.
Открытые системы обмениваются с окружающей средой веществом и энергией.
Закрытые системы обмениваются с окружающей средой только энергией, но не веществом.
Изолированные системы не обмениваются с окружающей средой ни веществом, ни энергией.
По фазовому состоянию различают гомогенные и гетерогенные системы.
Гомогенные системы состоят из одной фазы. Примеры гомогенных систем: любые истинные растворы – плазма крови, воздух, сплавы.
Гетерогенные системы состоят из двух и более фаз. Примеры гетерогенных систем: осадок и раствор над ним, две несмешивающиеся жидкости, цельная кровь.
Фаза – это гомогенная часть системы с одинаковыми во всех точках свойствами и отделенная от других частей системы поверхностями раздела.
Система может находиться в различных состояниях, каждое из которых характеризуется определенным набором термодинамических параметров. Параметр – это любое свойство системы: температура, объем, давление, масса, количество вещества и т.д. Любое изменение одного или нескольких параметров системы означает переход системы из одного состояния в другое или процессом. В каждом состоянии система обладает определенными энергетическими характеристиками, которые являются функциями состояния системы
|
|
|
Функции состояния системы – это энергетические характеристики системы, которые зависят только от параметров состояния системы и не зависят от того, каким способом это состояние было достигнуто.
Внутренняя энергия, теплота, работа.
Внутренняя энергия системы (U) – это кинетическая энергия движения и потенциальная энергия взаимодействия всех частиц, образующих систему (молекул, ионов, электронов, ядер и т.д.)
Свойства внутренней энергии:
1) Внутренняя энергия является функцией состояния системы, т.е. ее изменение (DU) не зависит от пути процесса, а определяется только начальным и конечным состоянием системы.
2) Абсолютное значение внутренней энергии не поддается определению, так как это требует учета слишком большого числа факторов, многие из которых современной науке неизвестны. Однако можно определить изменение внутренней энергии при переходе системы из одного состояния в другое. Этими относительными величинами и пользуются в термодинамических расчетах.
Энергообмен между системой и окружающей средой осуществляется путем совершения работы (А) или передачи теплоты (Q). Т.о., теплота и работа – формы передачи энергии.
Теплота – это микроскопическая форма передачи энергии путем хаотического движения частиц. Эта форма передачи энергии не имеет направления.
Работа – это макроскопическая форма передачи энергии путем перемещения масс под действием сил, она имеет направление.
Внутреннюю энергию, теплоту и работу измеряют в Дж и кДж.
|
|
|
В отличие от внутренней энергии, теплота и работа не являются функциями состояния системы. Их вклад в энергообмен между системой и окружающей средой при переходе системы из одного состояния в другое может быть различным в зависимости от пути этого перехода. Т.о., теплота и работа – функции пути.
В зависимости от направления энергообмена между системой и окружающей средой теплота и работа могут быть положительными или отрицательными. Положительной принято считать теплоту, поглощенную системой и работу, которую система совершает над окружающей средой.
Первый закон термодинамики
Первый закон термодинамики - это закон сохранения энергии для систем, в которых энергия выделяется или поглощается в виде теплоты или работы.
Поглощенная системой теплота расходуется на увеличение внутренней энергии системы и на совершение системой работы:
Q = D U + A (1)
При химических процессах чаще всего совершается работа расширения, равная pDV, которую выделяют из общей суммы:
A = A/ + pDV
где A/ - полезная работа;
р – внешнее давление;
DV- изменение объема системы.
Подставляя полученное выражение в уравнение (1), получаем:
Q = DU + A/ + p DV
В большинстве химических процессов полезная работа не совершается (исключение – работа гальванического элемента) и A/ = 0. Тогда:
Q = DU + p DV
Величина Q называется тепловым эффектом процесса.
Обычно химические процессы протекают при постоянстве одного из параметров.
р = const – изобарический процесс;
V= const – изохорический процесс;
T = const – изотермический процесс.
Рассмотрим вид первого начала термодинамики для изохорического и изобарического процессов.
1) V = const DV = 0
QV = DU
Тепловой эффект изохорного процесса QV равен изменению внутренней энергии системы.
2) p = const
QP = DU + p DV
DU = U2 - U1 DV = V2 - V1
Qp = (U2 - U1) + p (V2 - V1)
QP = (U2 + pV2) – (U1 + pV1)
U + pV = H – энтальпия
QP = H2 - H1
QP = DH
Тепловой эффект изобарического процесса QP равен изменению энтальпии системы. Для процессов, протекающих при p=const, изменения энтальпии и внутренней энергии связаны соотношением:
DH = DU + p DV
Энтальпия, как и внутренняя энергия, является функцией состояния системы. Ее абсолютное значение неизвестно. Экспериментально может быть определена величина DH, как тепловой эффект процесса, проведенного при p=const. Энтальпию измеряют в джоулях и килоджоулях.
|
|
|
Законы термохимии
Согласно первому закону термодинамики, в общем случае, теплота не является функцией состояния системы. Однако при p = const QP = DH, а при V = const QV = DU и, следовательно, в этих двух случаях теплота является функцией состояния системы, что и устанавливает закон Гесса:
Тепловой эффект химической реакции, протекающей при p = const или V = const не зависит от пути процесса, а определяется только начальным и конечным состояниями реагирующих веществ.
Тепловой эффект процесса может быть положительным (DH>0, теплота поглощается системой) или отрицательным (DH<0, теплота выделяется системой в окружающую среду). В первом случае процесс называется эндо-, а во втором – экзотермическим.
Для практических расчетов используются следствия из закона Гесса.
1-ое следствие:
Тепловой эффект процесса равен сумме тепловых эффектов отдельных стадий.
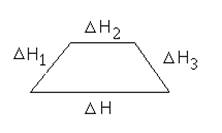
DH = DH1 + DH2 + DH3
2-ое следствие:
Тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции и исходных веществ с учетом их стехиометрических коэффициентов.
Для реакции:
a A + b B = c C + d D
DHр-ции = (c DHобр С + d DHобр D) – (a DHобр A + b DHобр B)
Теплота образования сложного вещества (DHобр) есть тепловой эффект процесса образования одного моля этого вещества из простых веществ в их устойчивых состояниях.
Так, теплотой образования карбоната кальция является тепловой эффект процесса:
Ca(к) + C (гр) + 3/2 O2(Г)= CaCO3(К) 
Стандартной теплотой образования химического соединения при данной температуре ( ) называется тепловой эффект реакции образования 1 моля этого вещества из простых веществ при стандартном состоянии (p=101325Па, c=1 моль/л, устойчивые модификации простых веществ)
) называется тепловой эффект реакции образования 1 моля этого вещества из простых веществ при стандартном состоянии (p=101325Па, c=1 моль/л, устойчивые модификации простых веществ)
Стандартные энтальпии образования простых веществ принимаются равными 0.
В таблицах приводятся величины стандартных энтальпий образования, измеренные при стандартной температуре 298К - 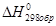 . Величина
. Величина  зависит от количества вещества и измеряется в кДж/моль.
зависит от количества вещества и измеряется в кДж/моль.
|
|
|
Уравнения, в которых приводится тепловой эффект процесса называются термохимическими уравнениями, например:
N2(г)+ 3 H2(г) =2 NH3(г) 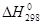 = - 92,4 кДж
= - 92,4 кДж
Особенности термохимических уравнений:
1) стехиометрические коэффициенты означают число молей, а не число молекул и поэтому могут быть дробными;
2) в них всегда указывается агрегатное состояние веществ и их модификация;
3) величина приводимого теплового эффекта соответствует тому числу молей веществ, которое определяется уравнением реакции;
4) к ним применимы математические операции, которые используются для алгебраических уравнений.
|
|
|


