 |
Для обратимых и необратимых процессов. Энтропия
|
|
|
|
I закон термодинамики не различает обратимые и необратимые процессы, на его основе нельзя сделать выводы о направлении протекания процесса и состоянии равновесия. II закон термодинамики устанавливает возможность, направление и предел (глубину) протекания самопроизвольных процессов.
II закон термодинамики, как и первый, является результатом обобщения человеческого опыта и является одним из фундаментальных законов природы. Он установлен в ходе исследований КПД тепловых машин. Машина, способная совершать работу только за счет поглощения теплоты из окружающей среды без передачи части теплоты другому телу (холодильнику) получила название вечный двигатель второго рода.
Не вся теплота, переданная системе от нагревателя, расходуется на совершение работы. Система (рабочее тело) совершая работу, должна периодически возвращаться в исходное состояние. Приведение рабочего тела в исходное состояние, требует отвод теплоты в окружающую среду, но уже другим телом (холодильником), имеющим более низкую температуру по сравнению с рабочим телом.
Существует несколько формулировок II закона термодинамики, которые вытекают одна из другой:
1. Постулат Оствальда: невозможно создание вечного двигателя II рода;
2. Постулат Клаузиуса: никакая совокупность процессов не может приводить к самопроизвольному переходу тепла от холодного тела к горячему, в то время как переход тепла от горячего тела к холодному может быть единственным результатом процесса;
3. Постулат Томсона: никакая совокупность процессов не может приводить к полному превращению теплоты в работу, в то время как превращение работы в теплоту может быть единственным результатом процесса.
|
|
|
Во всех формулировках II закона термодинамики указывается на невозможность самопроизвольного протекания определенного процесса. Здесь не имеется в виду, что эти процессы являются совершенно невозможными. Они наблюдаются в действительности, однако не могут протекать самопроизвольно.
Математическое выражение II закона термодинамики для обратимых и необратимых процессов записывается:

 , (20)
, (20)
где знак равенства соответствует обратимым процессам, а > – необратимым. Функцию 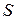 называют энтропией. Энтропия обладает всеми свойствами функции состояния.
называют энтропией. Энтропия обладает всеми свойствами функции состояния.
1.4.2. изменение энтропии как критерий направленности
Самопроизвольных процессов и равновесия
В изолированной системе
Рассмотрим какую-либо изолированную систему. Для изолированной системы  . С учетом этого уравнение II закона термодинамики имеет вид:
. С учетом этого уравнение II закона термодинамики имеет вид:
 . (21)
. (21)
Из выражения (21) следует, что при протекании обратимого равновесного процесса энтропия остается постоянной. Условием самопроизвольного протекания процесса в изолированной системе является неравенство  , т.е. возрастание энтропии. Процессы, сопровождающиеся уменьшением энтропии (
, т.е. возрастание энтропии. Процессы, сопровождающиеся уменьшением энтропии (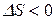 ) в изолированной системе неосуществимы. Если же протекание процесса возможно как в прямом, так и в обратном направлении, в изолированной системе процесс будет протекать в том направлении, которое сопровождается увеличением энтропии.
) в изолированной системе неосуществимы. Если же протекание процесса возможно как в прямом, так и в обратном направлении, в изолированной системе процесс будет протекать в том направлении, которое сопровождается увеличением энтропии.
При протекании самопроизвольных процессов в изолированной системе одновременно с увеличением энтропии система приближается к состоянию равновесия. Когда система достигнет состояния равновесия, все процессы прекращаются и энтропия становится максимальной. Условие равновесия в изолированной системе можно записать математически:

 .
.
Если система сложная, то в отдельных ее частях энтропия может уменьшаться, а в других увеличиваться, однако общая энтропия системы при этом должна увеличиваться.
|
|
|
1.4.3. расчет изменения энтропии при протекании различных
|
|
|


