 |
Практическая работа №6. Тема: «определение порядка констант скорости, энергии активации реакций. Катализ». Теоретическая Часть
|
|
|
|
ПРАКТИЧЕСКАЯ РАБОТА №6
Тема: «Определение порядка констант скорости, энергии активации реакций. Катализ»
Цель работы: расчет констант скорости реакции, энергии активации и характеристик процесс идущих в присутствии катализаторов.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Скорость химической реакции измеряется количеством вещества, вступающего в реакцию или образующегося в результате реакции в единицу времени в единице объема системы (для гомогенной реакции) или на единице площади поверхности раздела фаз (для гетерогенной реакции).
Константа скорости реакции I порядка:
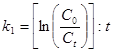 , мин-1, сек-1
, мин-1, сек-1
Для реакции II порядка константа скорости реакции : 
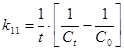 , мин-1, сек-1
, мин-1, сек-1
Константу скорости реакции для реакции I порядка можно определить по периоду полураспада:

Энергия активации 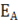 – некоторая избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение было эффективным, т. е. привело бы к образованию нового вещества.
– некоторая избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение было эффективным, т. е. привело бы к образованию нового вещества.
Расчет энергии активации:
 , [Дж]
, [Дж]
Катализатор – вещество, которое увеличивает скорость реакции, само оставаясь по окончании реакции химически неизменным. Наличие в системе катализатора может изменять константу скорости химического процесса и его скорость при заданных концентрациях реагентов.
Катализатор характеризуется:
Активность катализатора – относительное ускорение реакции под влиянием катализатора (Вк)
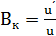
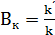
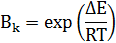
Производительность катализатора – характеристика ускоряющего действия твердого катализатора на производстве (Пк)
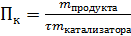 , [ч-1]
, [ч-1]
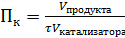 , [ч-1]
, [ч-1]
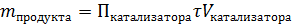 , [кг/ч]
, [кг/ч]
Селективность катализатора – характеристика направленности действия катализатора (Sк)
|
|
|
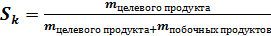 100 %
100 %
Часть 1: с 1 по 4 задачу
Часть 2: с 5 по 8 задачу
ПРАКТИЧЕСКАЯ ЧАСТЬ
Вариант №1
1. Кинетика реакции разложения Н202 → 2Н20 + 02 изучалась по выделению кислорода во времени. Получили следующие результаты:
| Замер | ||||
| Время, мин | ||||
| V (O2), см3 | 19, 3 | 26, 0 | 32, 6 | 36, 0 |
Определите порядок, период полураспада и константу скорости этой реакции.
2. Кинетика реакции образования фосгена CO + Cl2 → COCl2 изучалась путем наблюдения за изменением концентрации СО и Cl2 в смеси эквивалентного исходного состава. Получены следующие результаты:
| Замер | ||||
| Время, мин | ||||
| C × 103, моль/м3 | 18, 7 | 17, 9 | 17, 6 | 17, 3 |
Определите порядок, период полураспада и константу скорости этой реакции.
3. Константа скорости реакции: СО + Сl2 → COCl2 при 249 0С равна 14, 3, а при 295 0С равна 14, 5. Вычислите энергию активации этой реакции?
4. Энергия активации реакции: 2SO2+O2 → 2SO3, при 450 0С равна 280 кДж. Катализатор, приготовленный на основе оксида железа снижает энергию активации этой реакции до 160 кДж, при 630 0С, а катализаторы приготовленные на основе ванадия и платины и работающие при 460 0С, снижают до 92 и 68 кДж энергии. Рассчитайте активность указанных катализаторов.
5. При 25 0С константа скорости реакции СН3СООН + С2Н5ОН → СН3СООС2Н5+Н2О равна 3, 49·10-8. При ведении этой реакции в той же среде, но в присутствии раствора НСl константа скорости ее равна 1, 56·10-2. Рассчитайте каталитическую активность НСl.
6. Расход бутана в реактор дегидрирования равен 12000м3/ч. Объем катализатора в реакторе равен 45м3. Рассчитайте производительность катализатора.
7. При получении этанола прямой гидратацией этилена из 1000 кг газа получают 1460 кг спирта, 31 кг эфира, 30 кг смол и 15 кг альдегидов, 10 кг непрореагировавшегося газа. Какова селективность катализатора по спирту?
|
|
|
8. Рассчитайте объем катализатора для обеспечения работы установки по производству этанола гидратацией этилена производительностью 150 т/сут этанола, если производительность катализатора равна 200 кг/м3·ч по этанолу.
Вариант №2
1. Кинетика реакции разложения уксусной кислоты изучалась по изменению объема СО. Получены следующие результаты:
| Замер | ||||
| Время, мин | ||||
| V (CO), м3 |
Определите порядок, период полураспада и константу скорости этой реакции.
2. Кинетика реакции образования фосгена CO + Cl2 → COCl2 изучалась путем наблюдения за изменением концентрации СО и Cl2 в смеси эквивалентного исходного состава. Получены следующие результаты:
| Замер | ||||
| Время, мин | ||||
| C × 103, моль/м3 | 20, 7 | 19, 9 | 18, 6 | 17, 3 |
Определите порядок, период полураспада и константу скорости этой реакции.
3. Константа скорости реакции: СО + Сl2 → COCl2 при 259 0С равна 14, 2, а при 305 0С равна 14, 4. Вычислите энергию активации этой реакции?
4. Энергия активации реакции: 2SO2+O2 → 2SO3, при 460 0С равна 290 кДж. Катализатор, приготовленный на основе оксида железа снижает энергию активации этой реакции до 170 кДж, при 640 0С, а катализаторы приготовленные на основе ванадия и платины и работающие при 461 0С, снижают до 93 и 69 кДж энергии. Рассчитайте активность указанных катализаторов.
5. При 25 0С константа скорости реакции СН3СООН + С2Н5ОН → СН3СООС2Н5+Н2О равна 3, 48·10-8. При ведении этой реакции в той же среде, но в присутствии раствора НСl константа скорости ее равна 1, 55·10-2. Рассчитайте каталитическую активность НСl.
6. Расход бутана в реактор дегидрирования равен 11000м3/ч. Объем катализатора в реакторе равен 43 м3. Рассчитайте производительность катализатора.
7. При получении этанола прямой гидратацией этилена из 1000 кг газа получают 1450 кг спирта, 32 кг эфира, 28 кг смол и 14 кг альдегидов, 9 кг непрореагировавшегося газа. Какова селективность катализатора по спирту?
8. Рассчитайте объем катализатора для обеспечения работы установки по производству этанола гидратацией этилена производительностью 145 т/сут этанола, если производительность катализатора равна 180 кг/м3·ч по этанолу.
|
|
|
Вариант №3
1. При термическом разложении закиси азота 2 N20→ 2N2 + 02 при двух различных начальных концентрациях получена следующая зависимость концентрации N20 от времени:
| Замер | |||||
| Время, сек | |||||
| C × 103, моль/м3 | 0, 0158 | 0, 0132 | 0, 0093 | 0, 0072 | 0, 0059 |
Определите порядок, период полураспада и константу скорости этой реакции.
2. Кинетика реакции образования аммиака изучалась путем наблюдения за изменением концентрации азота и водорода. Получены следующие результаты:
| Замер | ||||
| Время, мин | ||||
| C × 103, моль/м3 | 21, 7 | 18, 9 | 17, 6 | 16, 3 |
Определите порядок, период полураспада и константу скорости этой реакции.
3. Константа скорости реакции: СО + Сl2 → COCl2 при 260 0С равна 14, 1, а при 315 0С равна 14, 3. Вычислите энергию активации этой реакции?
4. Энергия активации реакции: 2SO2+O2 → 2SO3, при 461 0С равна 291 кДж. Катализатор, приготовленный на основе оксида железа снижает энергию активации этой реакции до 171 кДж, при 641 0С, а катализаторы приготовленные на основе ванадия и платины и работающие при 462 0С, снижают до 94 и 70 кДж энергии. Рассчитайте активность указанных катализаторов.
5. При 25 0С константа скорости реакции СН3СООН + С2Н5ОН → СН3СООС2Н5+Н2О равна 3, 49·10-7. При ведении этой реакции в той же среде, но в присутствии раствора НСl константа скорости ее равна 1, 56·10-3. Рассчитайте каталитическую активность НСl.
6. Расход бутана в реактор дегидрирования равен 11500м3/ч. Объем катализатора в реакторе равен 43, 2 м3. Рассчитайте производительность катализатора.
7. При получении этанола прямой гидратацией этилена из 1000 кг газа получают 1440 кг спирта, 30 кг эфира, 28 кг смол и 13 кг альдегидов, 10 кг непрореагировавшегося газа. Какова селективность катализатора по спирту?
8. Рассчитайте объем катализатора для обеспечения работы установки по производству этанола гидратацией этилена производительностью 143 т/сут этанола, если производительность катализатора равна 181 кг/м3·ч по этанолу.
Вариант №4
1. При 300 0С разлагается с образованием углекислого газа. Во время разложения давление СО изменяется:
|
|
|
| Замер | ||||
| Время, час | 5, 65 | 6, 5 | ||
| Р (СО), мм. рт. ст |
Определите порядок, период полураспада и константу скорости этой реакции.
2. Кинетика реакции образования аммиака изучалась путем наблюдения за изменением концентрации азота и водорода. Получены следующие результаты:
| Замер | ||||
| Время, сек | ||||
| C × 103, моль/м3 | 21, 7 | 18, 9 | 17, 6 | 16, 3 |
Определите порядок, период полураспада и константу скорости этой реакции.
3. Константа скорости реакции: СО + Сl2 → COCl2 при 262 0С равна 14, 0, а при 325 0С равна 14, 2. Вычислите энергию активации этой реакции?
4. Энергия активации реакции: 2SO2+O2 → 2SO3, при 440 0С равна 270 кДж. Катализатор, приготовленный на основе оксида железа снижает энергию активации этой реакции до 150 кДж, при 620 0С, а катализаторы приготовленные на основе ванадия и платины и работающие при 450 0С, снижают до 82 и 58 кДж энергии. Рассчитайте активность указанных катализаторов.
5. При 25 0С константа скорости реакции СН3СООН + С2Н5ОН → СН3СООС2Н5+Н2О равна 3, 48·10-7. При ведении этой реакции в той же среде, но в присутствии раствора НСl константа скорости ее равна 1, 55·10-3. Рассчитайте каталитическую активность НСl.
6. Расход бутана в реактор дегидрирования равен 11550м3/ч. Объем катализатора в реакторе равен 40, 1 м3. Рассчитайте производительность катализатора.
7. При получении этанола прямой гидратацией этилена из 1100 кг газа получают 1439 кг спирта, 31 кг эфира, 29 кг смол и 15 кг альдегидов, 10 кг непрореагировавшегося газа. Какова селективность катализатора по спирту?
8. Рассчитайте объем катализатора для обеспечения работы установки по производству этанола гидратацией этилена производительностью 155 т/сут этанола, если производительность катализатора равна 205 кг/м3·ч по этанолу.
Вариант №5
1. Кинетика реакции разложения Н202 → 2Н20 + 02 изучалась по выделению кислорода во времени. Получили следующие результаты:
| Замер | ||||
| Время, сек | ||||
| V (O2), см3 | 19, 3 | 25, 0 | 33, 6 | 36, 0 |
Определите порядок, период полураспада и константу скорости этой реакции.
2. Кинетика реакции образования фосгена CO + Cl2 → COCl2 изучалась путем наблюдения за изменением концентрации СО и Cl2 в смеси эквивалентного исходного состава. Получены следующие результаты:
| Замер | ||||
| Время, час | 1, 5 | 1, 6 | ||
| C × 103, моль/м3 | 188, 7 | 171, 9 | 171, 6 | 171, 3 |
Определите порядок, период полураспада и константу скорости этой реакции.
|
|
|
3. Константа скорости реакции: СО + Сl2 → COCl2 при 449 0С равна 16, 3, а при 495 0С равна 16, 5. Вычислите энергию активации этой реакции?
4. Энергия активации реакции: 2SO2+O2 → 2SO3, при 445 0С равна 275 кДж. Катализатор, приготовленный на основе оксида железа снижает энергию активации этой реакции до 155 кДж, при 625 0С, а катализаторы приготовленные на основе ванадия и платины и работающие при 455 0С, снижают до 87 и 63 кДж энергии. Рассчитайте активность указанных катализаторов.
5. При 25 0С константа скорости реакции СН3СООН + С2Н5ОН → СН3СООС2Н5+Н2О равна 2, 93·10-8. При ведении этой реакции в той же среде, но в присутствии раствора НСl константа скорости ее равна 0, 56·10-2. Рассчитайте каталитическую активность НСl.
6. Расход бутана в реактор дегидрирования равен 12500м3/ч. Объем катализатора в реакторе равен 50, 1 м3. Рассчитайте производительность катализатора.
7. При получении этанола прямой гидратацией этилена из 1200 кг газа получают 1455 кг спирта, 30 кг эфира, 28 кг смол и 14 кг альдегидов, 9 кг непрореагировавшегося газа. Какова селективность катализатора по спирту?
8. Рассчитайте объем катализатора для обеспечения работы установки по производству этанола гидратацией этилена производительностью 145 т/сут этанола, если производительность катализатора равна 195 кг/м3·ч по этанолу.
Вариант №6
1. Кинетика реакции разложения Н202 → 2Н20 + 02 изучалась по выделению кислорода во времени. Получили следующие результаты:
| Замер | ||||
| Время, сек | ||||
| V (O2), см3 | 18, 3 | 27, 0 | 33, 6 | 37, 0 |
Определите порядок, период полураспада и константу скорости этой реакции.
2. Кинетика реакции образования фосгена CO + Cl2 → COCl2 изучалась путем наблюдения за изменением концентрации СО и Cl2 в смеси эквивалентного исходного состава. Получены следующие результаты:
| Замер | ||||
| Время, час | ||||
| C × 103, моль/м3 | 201, 7 | 200, 9 | 190, 6 | 170, 3 |
Определите порядок, период полураспада и константу скорости этой реакции.
3. Константа скорости реакции: СО + Сl2 → COCl2 при 450 0С равна 16, 4, а при 500 0С равна 16, 6. Вычислите энергию активации этой реакции?
4. Энергия активации реакции: 2SO2+O2 → 2SO3, при 443 0С равна 273 кДж. Катализатор, приготовленный на основе оксида железа снижает энергию активации этой реакции до 153 кДж, при 623 0С, а катализаторы приготовленные на основе ванадия и платины и работающие при 453 0С, снижают до 85 и 61 кДж энергии. Рассчитайте активность указанных катализаторов.
5. При 25 0С константа скорости реакции СН3СООН + С2Н5ОН → СН3СООС2Н5+Н2О равна 2, 83·10-8. При ведении этой реакции в той же среде, но в присутствии раствора НСl константа скорости ее равна 0, 55·10-2. Рассчитайте каталитическую активность НСl.
6. Расход бутана в реактор дегидрирования равен 12400м3/ч. Объем катализатора в реакторе равен 47, 1 м3. Рассчитайте производительность катализатора.
7. При получении этанола прямой гидратацией этилена из 1090 кг газа получают 1458 кг спирта, 32 кг эфира, 27 кг смол и 15 кг альдегидов, 9, 5 кг непрореагировавшегося газа. Какова селективность катализатора по спирту?
8. Рассчитайте объем катализатора для обеспечения работы установки по производству этанола гидратацией этилена производительностью 146 т/сут этанола, если производительность катализатора равна 194 кг/м3·ч по этанолу.
Вариант №7
1. Кинетика реакции разложения уксусной кислоты изучалась по изменению объема СО. Получены следующие результаты:
| Замер | ||||
| Время, сек | ||||
| V (CO), м3 | 49, 1 | 188, 2 | 1580, 1 | 1600, 1 |
Определите порядок, период полураспада и константу скорости этой реакции.
2. Кинетика реакции образования фосгена CO + Cl2 → COCl2 изучалась путем наблюдения за изменением концентрации СО и Cl2 в смеси эквивалентного исходного состава. Получены следующие результаты:
| Замер | ||||
| Время, час | 0, 23 | 0, 31 | 0, 43 | |
| C × 103, моль/м3 | 21, 7 | 18, 9 | 18, 6 | 16, 3 |
Определите порядок, период полураспада и константу скорости этой реакции.
3. Константа скорости реакции: СО + Сl2 → COCl2 при 360 0С равна 15, 4, а при 400 0С равна 15, 6. Вычислите энергию активации этой реакции?
4. Энергия активации реакции: 2SO2+O2 → 2SO3, при 451 0С равна 281 кДж. Катализатор, приготовленный на основе оксида железа снижает энергию активации этой реакции до 161 кДж, при 631 0С, а катализаторы приготовленные на основе ванадия и платины и работающие при 460 0С, снижают до 93 и 69 кДж энергии. Рассчитайте активность указанных катализаторов.
5. При 25 0С константа скорости реакции СН3СООН + С2Н5ОН → СН3СООС2Н5+Н2О равна 2, 93·10-7. При ведении этой реакции в той же среде, но в присутствии раствора НСl константа скорости ее равна 0, 56·10-3. Рассчитайте каталитическую активность НСl.
6. Расход бутана в реактор дегидрирования равен 12445 м3/ч. Объем катализатора в реакторе равен 52, 1 м3. Рассчитайте производительность катализатора.
7. При получении этанола прямой гидратацией этилена из 1080 кг газа получают 1448 кг спирта, 29 кг эфира, 29 кг смол и 15 кг альдегидов, 8, 5 кг непрореагировавшегося газа. Какова селективность катализатора по спирту?
8. Рассчитайте объем катализатора для обеспечения работы установки по производству этанола гидратацией этилена производительностью 147 т/сут этанола, если производительность катализатора равна 190 кг/м3·ч по этанолу.
Вариант №8
1. При термическом разложении закиси азота 2 N20→ 2N2 + 02 при двух различных начальных концентрациях получена следующая зависимость концентрации N20 от времени:
| Замер | |||||
| Время, сек | |||||
| C × 103, моль/м3 | 0, 0159 | 0, 0133 | 0, 0094 | 0, 0073 | 0, 006 |
Определите порядок, период полураспада и константу скорости этой реакции.
2. Кинетика реакции образования аммиака изучалась путем наблюдения за изменением концентрации азота и водорода. Получены следующие результаты:
| Замер | ||||
| Время, мин | ||||
| C × 103, моль/м3 | 25, 7 | 20, 9 | 19, 6 | 14, 3 |
Определите порядок, период полураспада и константу скорости этой реакции.
3. Константа скорости реакции: СО + Сl2 → COCl2 при 362 0С равна 15, 5, а при 402 0С равна 15, 7. Вычислите энергию активации этой реакции?
4. Энергия активации реакции: 2SO2+O2 → 2SO3, при 465 0С равна 295 кДж. Катализатор, приготовленный на основе оксида железа снижает энергию активации этой реакции до 175 кДж, при 645 0С, а катализаторы приготовленные на основе ванадия и платины и работающие при 465 0С, снижают до 97 и 70 кДж энергии. Рассчитайте активность указанных катализаторов.
5. При 25 0С константа скорости реакции СН3СООН + С2Н5ОН → СН3СООС2Н5+Н2О равна 2, 83·10-7. При ведении этой реакции в той же среде, но в присутствии раствора НСl константа скорости ее равна 0, 55·10-3. Рассчитайте каталитическую активность НСl.
6. Расход бутана в реактор дегидрирования равен 12002 м3/ч. Объем катализатора в реакторе равен 32, 2 м3. Рассчитайте производительность катализатора.
7. При получении этанола прямой гидратацией этилена из 1070 кг газа получают 1458 кг спирта, 30 кг эфира, 27 кг смол и 14 кг альдегидов, 10 кг непрореагировавшегося газа. Какова селективность катализатора по спирту?
8. Рассчитайте объем катализатора для обеспечения работы установки по производству этанола гидратацией этилена производительностью 148 т/сут этанола, если производительность катализатора равна 192 кг/м3·ч по этанолу.
Вариант №9
1. При 300°С СО разлагается с образованием С02. Во время разложения давление СО изменяется:
| Замер | ||||
| Время, мин | ||||
| Р (СО), мм. рт. ст |
Определите порядок, период полураспада и константу скорости этой реакции.
2. Кинетика реакции образования аммиака изучалась путем наблюдения за изменением концентрации азота и водорода. Получены следующие результаты:
| Замер | ||||
| Время, сек | ||||
| C × 103, моль/м3 | 21, 7 | 18, 9 | 17, 6 | 16, 3 |
Определите порядок, период полураспада и константу скорости этой реакции.
3. Константа скорости реакции: СО + Сl2 → COCl2 при 372 0С равна 16, 5, а при 422 0С равна 16, 7. Вычислите энергию активации этой реакции?
4. Энергия активации реакции: 2SO2+O2 → 2SO3, при 470 0С равна 300 кДж. Катализатор, приготовленный на основе оксида железа снижает энергию активации этой реакции до 180 кДж, при 650 0С, а катализаторы приготовленные на основе ванадия и платины и работающие при 468 0С, снижают до 100 и 80 кДж энергии. Рассчитайте активность указанных катализаторов.
5. При 25 0С константа скорости реакции СН3СООН + С2Н5ОН → СН3СООС2Н5+Н2О равна 4, 5·10-8. При ведении этой реакции в той же среде, но в присутствии раствора НСl константа скорости ее равна 2, 5·10-2. Рассчитайте каталитическую активность НСl.
6. Расход бутана в реактор дегидрирования равен 12000 м3/ч. Объем катализатора в реакторе равен 45, 3м3. Рассчитайте производительность катализатора.
7. При получении этанола прямой гидратацией этилена из 1060 кг газа получают 1438 кг спирта, 25 кг эфира, 27 кг смол и 14, 1 кг альдегидов, 8 кг непрореагировавшегося газа. Какова селективность катализатора по спирту?
8. Рассчитайте объем катализатора для обеспечения работы установки по производству этанола гидратацией этилена производительностью 142 т/сут этанола, если производительность катализатора равна 189 кг/м3·ч по этанолу.
Вариант №10
1. Кинетика реакции разложения Н202 → 2Н20 + 02 изучалась по выделению кислорода во времени. Получили следующие результаты:
| Замер | ||||
| Время, сек | ||||
| V (O2), см3 | 18, 3 | 26, 0 | 32, 6 | 37, 0 |
Определите порядок, период полураспада и константу скорости этой реакции.
2. Кинетика реакции образования фосгена CO + Cl2 → COCl2 изучалась путем наблюдения за изменением концентрации СО и Cl2 в смеси эквивалентного исходного состава. Получены следующие результаты:
| Замер | ||||
| Время, час | 1, 5 | 1, 54 | 1, 67 | |
| C × 103, моль/м3 | 187, 7 | 172, 9 | 172, 6 | 172, 3 |
Определите порядок, период полураспада и константу скорости этой реакции.
3. Константа скорости реакции: СО + Сl2 → COCl2 при 370 0С равна 16, 4, а при 420 0С равна 16, 8. Вычислите энергию активации этой реакции?
4. Энергия активации реакции: 2SO2+O2 → 2SO3, при 455 0С равна 285 кДж. Катализатор, приготовленный на основе оксида железа снижает энергию активации этой реакции до 165 кДж, при 635 0С, а катализаторы приготовленные на основе ванадия и платины и работающие при 465 0С, снижают до 97 и 73 кДж энергии. Рассчитайте активность указанных катализаторов.
5. При 25 0С константа скорости реакции СН3СООН + С2Н5ОН → СН3СООС2Н5+Н2О равна 4, 5·10-7. При ведении этой реакции в той же среде, но в присутствии раствора НСl константа скорости ее равна 2, 5·10-3. Рассчитайте каталитическую активность НСl.
6. Расход бутана в реактор дегидрирования равен 11000 м3/ч. Объем катализатора в реакторе равен 47, 2 м3. Рассчитайте производительность катализатора.
7. При получении этанола прямой гидратацией этилена из 1050 кг газа получают 1457 кг спирта, 30 кг эфира, 26 кг смол и 14, 9 кг альдегидов, 10 кг непрореагировавшегося газа. Какова селективность катализатора по спирту?
8. Рассчитайте объем катализатора для обеспечения работы установки по производству этанола гидратацией этилена производительностью 141 т/сут этанола, если производительность катализатора равна 190 кг/м3·ч по этанолу.
Вариант №11
1. Кинетика реакции разложения Н202 → 2Н20 + 02 изучалась по выделению кислорода во времени. Получили следующие результаты:
| Замер | ||||
| Время, мин | ||||
| V (O2), см3 | 21, 3 | 27, 0 | 34, 6 | 38, 0 |
Определите порядок, период полураспада и константу скорости этой реакции.
2. Кинетика реакции образования фосгена CO + Cl2 → COCl2 изучалась путем наблюдения за изменением концентрации СО и Cl2 в смеси эквивалентного исходного состава. Получены следующие результаты:
| Замер | ||||
| Время, сек | ||||
| C × 103, моль/м3 | 188, 7 | 171, 9 | 171, 6 | 171, 3 |
Определите порядок, период полураспада и константу скорости этой реакции.
3. Константа скорости реакции: СО + Сl2 → COCl2 при 239 0С равна 13, 3 а при 285 0С равна 13, 5. Вычислите энергию активации этой реакции?
4. Энергия активации реакции: 2SO2+O2 → 2SO3, при 456 0С равна 286 кДж. Катализатор, приготовленный на основе оксида железа снижает энергию активации этой реакции до 166 кДж, при 636 0С, а катализаторы приготовленные на основе ванадия и платины и работающие при 466 0С, снижают до 98 и 73 кДж энергии. Рассчитайте активность указанных катализаторов.
5. При 25 0С константа скорости реакции СН3СООН + С2Н5ОН → СН3СООС2Н5+Н2О равна 4, 4·10-6. При ведении этой реакции в той же среде, но в присутствии раствора НСl константа скорости ее равна 2, 2·10-3. Рассчитайте каталитическую активность НСl.
6. Расход бутана в реактор дегидрирования равен 11555 м3/ч. Объем катализатора в реакторе равен 44, 2 м3. Рассчитайте производительность катализатора.
7. При получении этанола прямой гидратацией этилена из 1040 кг газа получают 1456 кг спирта, 31 кг эфира, 29 кг смол и 14 кг альдегидов, 9 кг непрореагировавшегося газа. Какова селективность катализатора по спирту?
8. Рассчитайте объем катализатора для обеспечения работы установки по производству этанола гидратацией этилена производительностью 140 т/сут этанола, если производительность катализатора равна 195 кг/м3·ч по этанолу.
Вариант №12
1. Кинетика реакции разложения Н202 → 2Н20 + 02 изучалась по выделению кислорода во времени. Получили следующие результаты:
| Замер | ||||
| Время, сек | ||||
| V (O2), см3 | 18, 33 | 27, 1 | 33, 7 | 37, 1 |
Определите порядок, период полураспада и константу скорости этой реакции.
2. Кинетика реакции образования фосгена CO + Cl2 → COCl2 изучалась путем наблюдения за изменением концентрации СО и Cl2 в смеси эквивалентного исходного состава. Получены следующие результаты:
| Замер | ||||
| Время, час | 1, 5 | 2, 5 | 3, 5 | |
| C × 103, моль/м3 | 200, 7 | 180, 9 | 180, 6 | 170, 3 |
Определите порядок, период полураспада и константу скорости этой реакции.
3. Константа скорости реакции: СО + Сl2 → COCl2 при 339 0С равна 15, 1, а при 385 0С равна 15, 4. Вычислите энергию активации этой реакции?
4. Энергия активации реакции: 2SO2+O2 → 2SO3, при 441 0С равна 271 кДж. Катализатор, приготовленный на основе оксида железа снижает энергию активации этой реакции до 151 кДж, при 621 0С, а катализаторы приготовленные на основе ванадия и платины и работающие при 451 0С, снижают до 83 и 59 кДж энергии. Рассчитайте активность указанных катализаторов.
5. При 25 0С константа скорости реакции СН3СООН + С2Н5ОН → СН3СООС2Н5+Н2О равна 4, 4·10-7. При ведении этой реакции в той же среде, но в присутствии раствора НСl константа скорости ее равна 2, 1·10-3. Рассчитайте каталитическую активность НСl.
6. Расход бутана в реактор дегидрирования равен 10555 м3/ч. Объем катализатора в реакторе равен 43, 1 м3. Рассчитайте производительность катализатора.
7. При получении этанола прямой гидратацией этилена из 1030 кг газа получают 1458 кг спирта, 31, 2 кг эфира, 28 кг смол и 13 кг альдегидов, 7 кг непрореагировавшегося газа. Какова селективность катализатора по спирту?
8. Рассчитайте объем катализатора для обеспечения работы установки по производству этанола гидратацией этилена производительностью 139 т/сут этанола, если производительность катализатора равна 170 кг/м3·ч по этанолу.
Вариант №13
1. Кинетика реакции разложения уксусной кислоты изучалась по изменению объема СО. Получены следующие результаты:
| Замер | ||||
| Время, сек | ||||
| V (CO), м3 | 49, 1 | 188, 2 | 1580, 1 | 1600, 1 |
Определите порядок, период полураспада и константу скорости этой реакции.
2. Кинетика реакции образования фосгена CO + Cl2 → COCl2 изучалась путем наблюдения за изменением концентрации СО и Cl2 в смеси эквивалентного исходного состава. Получены следующие результаты:
| Замер | ||||
| Время, час | 0, 22 | 0, 32 | 0, 44 | |
| C × 103, моль/м3 | 20, 7 | 18, 8 | 18, 5 | 15, 3 |
Определите порядок, период полураспада и константу скорости этой реакции.
3. Константа скорости реакции: СО + Сl2 → COCl2 при 329 0С равна 14, 1, а при 365 0С равна 14, 3. Вычислите энергию активации этой реакции?
4. Энергия активации реакции: 2SO2+O2 → 2SO3, при 462 0С равна 292 кДж. Катализатор, приготовленный на основе оксида железа снижает энергию активации этой реакции до 172 кДж, при 642 0С, а катализаторы приготовленные на основе ванадия и платины и работающие при 463 0С, снижают до 95 и 71 кДж энергии. Рассчитайте активность указанных катализаторов.
5. При 25 0С константа скорости реакции СН3СООН + С2Н5ОН → СН3СООС2Н5+Н2О равна 3, 3·10-8. При ведении этой реакции в той же среде, но в присутствии раствора НСl константа скорости ее равна 1, 55·10-2. Рассчитайте каталитическую активность НСl.
6. Расход бутана в реактор дегидрирования равен 11122 м3/ч. Объем катализатора в реакторе равен 44, 8 м3. Рассчитайте производительность катализатора.
7. При получении этанола прямой гидратацией этилена из 1020 кг газа получают 1457 кг спирта, 30 кг эфира, 27 кг смол и 14 кг альдегидов, 9 кг непрореагировавшегося газа. Какова селективность катализатора по спирту?
8. Рассчитайте объем катализатора для обеспечения работы установки по производству этанола гидратацией этилена производительностью 148 т/сут этанола, если производительность катализатора равна 175 кг/м3·ч по этанолу.
Вариант №14
1. При термическом разложении закиси азота 2 N20→ 2N2 + 02 при двух различных начальных концентрациях получена следующая зависимость концентрации N20 от времени:
| Замер | |||||
| Время, сек | |||||
| C × 103, моль/м3 | 0, 0159 | 0, 0133 | 0, 0094 | 0, 0073 | 0, 006 |
Определите порядок, период полураспада и константу скорости этой реакции.
2. Кинетика реакции образования аммиака изучалась путем наблюдения за изменением концентрации азота и водорода. Получены следующие результаты:
| Замер | ||||
| Время, мин | ||||
| C × 1 |
|
|
|


