 |
Электрохимические источники тока
|
|
|
|
Электрохимические процессы – химические процессы, которые сопровождаются возникновением электрического тока или, наоборот, сами вызываются им.
Рассмотрим явления, происходящие на границе электрод – раствор.
Электродные потенциалы.
Электрическим потенциалом называют величину, соответствующую энергии, которую нужно затратить или которую можно получить при переносе единицы электричества из бесконечности в данную точку.
Электродный потенциал – скачок потенциала, возникающий под влиянием ряда факторов, на границе металл – раствор электролита.
Рассмотрим для простоты равновесие между металлом и раствором какой-нибудь соли того же металла. Металлы, ионы которых обладают значительной способностью к переходу в раствор, будут заряжаться в таком растворе отрицательно, но в меньшей степени, чем в чистой воде. А металлы, ионы которых обладают слабой способностью к такому растворению, будут заряжаться при этом даже положительно вследствие того, что имеющиеся в растворе положительные ионы выделяются на металле первоначально с большей скоростью, чем происходит переход ионов из металла в раствор.
Если металл заряжен отрицательно (рисунок 6), то катионы, находящиеся в растворе вблизи него, притягиваясь металлом, концентрируются около него, в особенности в слое, непосредственно прилегающем к поверхности металла. Анионы же отталкиваются металлом, и их концентра-
 Рис. 6. Двойной электрический слой
Рис. 6. Двойной электрический слой
| ция в растворе вблизи металла будет понижена, в особенности в слое, непосредственно прилегающем к поверхности металла. В результате раствор вблизи металла приобретает электрический заряд, противоположный по знаку заряду самого металла. Образуется, как принято говорить, двойной электрический слой. |
Таким образом, при погружении металла в воду или в раствор, содержащий ионы данного металла, на поверхности раздела металл – раствор образуется двойной электрический слой и возникает разность потенциалов (скачок потенциала) между металлом и раствором.
|
|
|
Понятие о стандартных электродных потенциалах.
Обычно определяют относительные электродные потенциалы. С этой целью измеряют ЭДС гальванического элемента, составленного из стандартного (нормального) водородного электрода, потенциал которого принимают за 0, и электродом исследуемого металла (рисунок 7).
Стандартный водородный электрод представляет собой платиновую пластину, покрытую слоем мелкораздробленной платины, насыщенную водородом при давлении 0,1 МПа и погруженную в 1н раствор серной кислоты (рисунок 8). Насыщенная водородом платиновая пластинка ведет себя как водородный электрод, у поверхности которого устанавливается равновесие:  .
.
Стандартный электродный потенциал металла – разность потенциалов между металлом, погруженным в раствор своей соли с концентрацией ионов металла 1 моль/л, и стандартным водородным электродом (мы будем обозначать ее буквой j).
 Рис. 7. Схема определения электродного потенциала
Рис. 7. Схема определения электродного потенциала
|  Рис. 8. Водородный электрод
Рис. 8. Водородный электрод
|
Ряд электродных потенциалов называют также рядом напряжений (“вытеснительный ряд” Н.Н. Бекетова):
Каждый левее стоящий металл вытесняет каждый правее стоящий металл из раствора его соли. Металл с меньшим потенциалом всегда будет окисляться (анодом), с большим – восстанавливаться (катодом).
Уравнение Нернста.
Зависимость электродного потенциала от концентрации одноименных ионов в растворе описывается уравнением НЕРНСТА:
 (78),
(78),
или  (79) (при Т=298 К)
(79) (при Т=298 К)
где  – стандартный (нормальный) электродный потенциал металла, В;
– стандартный (нормальный) электродный потенциал металла, В;
|
|
|
 – универсальная газовая постоянная, 8,314 Дж/(моль×К);
– универсальная газовая постоянная, 8,314 Дж/(моль×К);
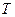 – температура, К;
– температура, К; 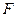 – постоянная Фарадея, 96500Кл/моль;
– постоянная Фарадея, 96500Кл/моль;
 – активность ионов металла в растворе, моль/л;
– активность ионов металла в растворе, моль/л;
 – число электронов, принятых или отданных в ходе реакции.
– число электронов, принятых или отданных в ходе реакции.
Гальванические элементы.
 Рис. 9. Элемент Якоби-Даниэля. 1 – металлические электроды; 2 – растворы солей; 3 – солевой мостик; 4 – гальванометр
Рис. 9. Элемент Якоби-Даниэля. 1 – металлические электроды; 2 – растворы солей; 3 – солевой мостик; 4 – гальванометр
|
Гальванический элемент – это устройство, в котором химическая энергия непосредственно превращается в электрическую.
Устройство и принцип работы гальванических элементов рассмотрим на примере элемента Якоби-Даниэля. Элемент Якоби-Даниэля состоит из двух металлических электродов (медного и цинкового) погруженных в растворы солей этих металлов (рисунок 9). Потенциал медного электрода можно рассчитать по формуле  , аналогично, потенциал цинкового электрода будет равен
, аналогично, потенциал цинкового электрода будет равен  . Если концентрации ионов Cu2+ и Zn2+ в растворах равны между собой и равны 1 моль/л, то такой элемент называется стандартным.
. Если концентрации ионов Cu2+ и Zn2+ в растворах равны между собой и равны 1 моль/л, то такой элемент называется стандартным.
Для нахождения ЭДС гальванического элемента от потенциала катода необходимо вычесть потенциал анода  . В данном элементе катодом является медный электрод, а анодом – цинковый.
. В данном элементе катодом является медный электрод, а анодом – цинковый.
Тогда 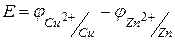 .
.
Подставим значения потенциалов электродов.
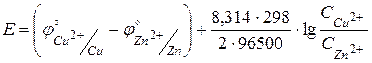 .
.
Значения стандартных окислительно-восстановительных потенциалов для меди и цинка равны соответственно  ,
, 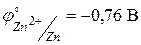 . Тогда ЭДС стандартного элемента Якоби-Даниэля будет равна
. Тогда ЭДС стандартного элемента Якоби-Даниэля будет равна  .
.
При работе гальванического элемента на катоде будет протекать реакция  , а на аноде
, а на аноде  . Электроны во внешней цепи будут перемещаться от цинкового электрода к медному.
. Электроны во внешней цепи будут перемещаться от цинкового электрода к медному.
Суммарная реакция, протекающая в данном элементе

Схематическая запись элемента Якоби-Даниэля

При работе элемента концентрация ионов цинка будет увеличиваться, а концентрация ионов меди – уменьшаться. Поэтому при работе элемента его ЭДС со временем уменьшается. В подобных гальванических элементах можно использовать и другие металлические электроды.
Электролиз
 Рис. 10. Схема прибора для электролиза. 1 – электроды, 2 ‑ электролит, 3 – источник тока, 4 – внешняя цепь
Рис. 10. Схема прибора для электролиза. 1 – электроды, 2 ‑ электролит, 3 – источник тока, 4 – внешняя цепь
|
Электролиз – это окислительно-восстановительная реакция, протекающая на электродах под действием электрического тока.
Общая схема установки для проведения электролиза изображена на рисунке 10. Она состоит из двух электродов, погруженных в раствор электролита и внешнего источника тока.
|
|
|
При проведении электролиза катод заряжен отрицательно, а анод – положительно. Рассмотрим электролиз водных растворов различных веществ.
Возможные варианты катодных процессов (восстановления) если катион:
1. это 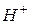 – в этом случае катодный процесс записывается следующим образом:
– в этом случае катодный процесс записывается следующим образом: 
2. это ион металла, находящегося в электрохимическом ряду напряжений после водорода: 
3. это ион металла, находящегося в электрохимическом ряду напряжений до алюминия включительно: 
4. это ион металла, находящегося в электрохимическом ряду напряжений между Al и Н. Для этих ионов одновременно протекают реакции как их восстановления, так и реакция восстановления воды с выделением Н2. Но в уравнение реакции записывают только восстановление металла.

Возможные варианты анодных процессов (окисления) если анион:
1. это гидроксид ион  , то анодный процесс записывается следующим образом:
, то анодный процесс записывается следующим образом: 
2. это бескислородсодержащие анионы  ,
,  ,
,  (
( ), то уравнение:
), то уравнение: 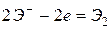
3. это анионы кислородсодержащих кислот ( ,
,  ,
,  ) и
) и  , то уравнение:
, то уравнение: 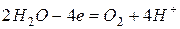
Рассмотрим примеры записей уравнений реакций электролиза для различных веществ.
1. Электролиз водного раствора серной кислоты

Катодный процесс 
Анодный процесс 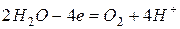
Суммарно 
После сокращения 
2. Электролиз водного раствора хлорида меди (II)

Катодный процесс 
Анодный процесс 
Суммарно 
После сокращения  или
или 
3. Электролиз водного раствора нитрата серебра

Катодный процесс 
Анодный процесс 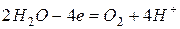
Суммарно 
После сокращения  или
или 
Рассмотренные примеры электродных процессов справедливы для инертных электродов, т.е. для электродов, не принимающих участие в электрохимическом процессе. Если материал электрода изменяется в процессе электролиза, то его называют активным электродом. Рассмотрим процесс электролиза водного раствора CuSO4 с активным анодом (медным). Отличительной особенностью процесса электролиза с активным анодом является то, что происходит окисление материала электрода, а не компонентов раствора.
|
|
|

Катодный процесс 
Анодный процесс 
Суммарно 
После сокращения 
Таким образом, при электролизе водного раствора CuSO4 с медными электродами происходит перенос меди с анода на катод, а состав электролита не изменяется.
|
|
|


