 |
Порядок вимірів. Лабораторна робота № 8.3 "Визначення питомої теплоти паротворення води".. 8.3.1. Фазові переходи.
|
|
|
|
Порядок вимірів.
1. Обгорнути резервуар правого термометра батистом.
2. Змочити батист дистильованою водою з гумового балона з піпеткою, увівши піпетку у внутрішню трубку захисту. Виждавши якийсь час і не виймаючи піпетки з трубки, розтиснути затиск на піпетці, забрати зайву воду в балон і вийняти піпетку.
3. Завести майже до відмови пружину вентилятора психрометра і запустити його.
4. Через 4 хвилини після пуску вентилятора зробити відлік температур Тзм і Тс по змоченому і сухому термометрах з точністю до 0, 1 С.
5. Визначити по психрометричній таблиці відносну вологість повітря в лабораторії:
- знайти стовпець, що відповідає показанню сухого термометра, тобто температурі повітря,
- знайти рядок, що відповідає показанню змоченого термометра,
- на перетині стовпця і рядка прочитати значення відносної вологості j і записати до протоколу.
6. Визначення відносної вологості по п. п. 2-5 повторити ще 4 рази.
7. Виміряти за допомогою барометра атмосферний тиск Р у Па.
Порядок розрахунків:
- Розрахувати середнє значення відносної вологості повітря < j> .
- Визначити по довіднику тиск насиченої водяної пари в Па, що відповідає вимірюваній температурі повітря Тс.
- Розрахувати тиск водяної пари Рвп за даних умов

- Розрахувати абсолютну вологість повітря rвп
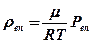
- Розрахувати відносний вміст водяної пари в лабораторії
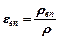
- В остаточний результат записати: < j> , Рвп, rвп , eвп.
Лабораторна робота № 8. 3 " Визначення питомої теплоти паротворення води".
Мета роботи: вивчення фазових переходів у речовині, залежності питомої теплоти паротворення від параметрів молекул, методів експериментального визначення питомої теплоти паротворення, визначення питомої теплоти паротворення води, оцінка на цій основі глибини потенційної ями парної взаємодії і діаметра молекул води.
|
|
|
8. 3. 1. Фазові переходи.
Під фазою розуміється сукупність усіх частин гомогенної термодинамічної системи, обмежених поверхнями розділу і які характеризуються при відсутності зовнішніх силових полів однаковими фізичними властивостями у всіх точках. Наприклад, суміш газів, розчин складаються з однієї фази, а система лід - вода - водяна пара з трьох фаз. У системі може бути кілька твердих чи рідких фаз. Але вона не може містити більш однієї газоподібної фази, тому що всі гази змішуються між собою.
Часте поняття фаза вживається в змісті агрегатного стану, під яким розуміється стан тієї самої речовини, що відрізняється характером теплового руху частинок (атомів чи молекул).
Фазовим переходом називається рівновага двох співіснуючих фаз: газу і рідини, рідини і твердого тіла, газу і твердого тіла.. Прикладом фазового переходу можуть служити зміни агрегатного стану речовини і переходи, зв'язані зі зміною в складі, структурі і властивостях речовини (наприклад, перехід кристалічної речовини з однієї модифікації в іншу). Розрізняють фазові переходи першого і другого роду.
Фазовим переходом першого роду називається перехід, що характеризується одночасною сталістю тиску і температури, що супроводжується стрибкоподібною зміною густини і внутрішньої енергії. Фазовий перехід першого роду завжди відбувається з поглинанням чи виділенням деякої кількості теплоти - теплоти фазового переходу. Наприклад, кипіння, плавлення, перехід з однієї кристалічної модифікації в іншу. При таких переходах вся теплота, яка підводиться, йде не на нагрівання тіла, а на руйнування кристалічних ґрат або на розрив міжатомних зв'язків. Тому такий перехід відбувається при сталій температурі. При подібних переходах з більш упорядкованого кристалічного стану в менш упорядкований рідкий чи газоподібний ступінь безладдя збільшується, тобто цей процес зв'язаний зі зростанням ентропії системи.
|
|
|
При зворотних переходах з газоподібного в рідкий чи твердий стан, якщо з системи вилучається теплота, то ентропія системи зменшується, і вона переходить у більш упорядкований стан.
Фазовим переходом другого роду називається перехід, не зв'язаний з поглинанням чи виділенням теплоти і зміною густини, але супроводжується стрибкоподібною зміною теплоємності і коефіцієнта стисливості. Фазові переходи другого роду зв'язані зі зміною симетрії: вище точки переходу система має більш високу симетрію, чим нижче точки переходу.
Прикладами фазових переходів другого роду є: перехід феромагнітних речовин при визначених тиску і температурі в парамагнітний стан, перехід деяких металів і сплавів при наднизьких температурах у надпровідний стан, який характеризується стрибкоподібним зменшенням електричного опору до нуля, перетворення звичайного рідкого гелію при Т = 2, 19 К в іншу рідину, що має властивості надтекучості (протікання крізь вузькі щілини і капіляри без тертя).
Для геометричного зображення фазових переходів використовується діаграма стану (рис. 8. 3), на якій у координатах Р, Т приводиться залежність між температурою фазового переходу і тиском у вигляді кривих випаровування (КВ), плавлення (КП) і сублімації (КС), що розділяють поле діаграми на три області, які відповідають умовам існування твердої (ТТ), рідкої (Ж) і газоподібної (Г) фаз. Криві на діаграмі називаються кривими фазової рівноваги. Кожна точка на них відповідає умовам рівноваги двох співіснуючих фаз: КП - твердого тіла і рідини, КИ - рідини і газу, КС - твердого тіла і газу.
Точка, у якій перетинаються ці криві і яка визначає умови (температуру Ттр і відповідний їй рівноважний тиск Ртр ) одночасного співіснування трьох фаз, називається потрійною точкою. Кожна речовина має тільки одну потрійну точку (для води Ттр = 273, 16 К и Ртр = 609 Па). Крива випаровування закінчується критичною точкою К. В ній зника різниця між двома фазами, тобто їх густини стають рівними спільній густині rк при критичних тиску Рк і температурі Тк.
|
|
|
Зміна тиску фазового переходу в залежності від зміни температури при процесі, який протікає вздовж КВ (рис. 8. 3), визначається рівнянням Клапейрона – Клаузиуса для тиску насиченої пари Ps(T):
 (8. 23)
(8. 23)
де V1 і V2 - відповідно питомі об’єми речовини у вихідній і кінцевій фазі, Т и P - температура і тиск фазового переходу, r - питома теплота фазового переходу - кількість теплоти, необхідної для перетворення 1 кг речовини з одного агрегатного стану в інший при сталій температурі і тиску. Це рівняння дозволяє визначити нахили кривої рівноваги за знаком похідної dPS/dT.
При випаровуванні рідин і сублімації твердих тіл об’єм речовини завжди зростає, тому dPS/dT > 0 і підвищення зовнішнього тиску приводить до збільшення температури. При плавленні твердих тіл об’єм може збільшуватися (у більшості речовин) і зменшуватися (вода, чавун, вісмут і ін. ). Для другого випадку збільшення тиску супроводжується зниженням температури плавлення (пунктирна крива на рис. ).
Діаграма стану, побудована на основі експериментальних даних, дозволяє визначити, у якому стані знаходиться речовина при визначених значеннях Р і Т, а також які фазові переходи будуть відбуватися при тому чи іншому процесі.
Випаровуванням називається процес переходу рідини в газоподібний стан (пара). Випаровування з поверхні відбувається при будь-якій температурі. Так як він полягає у відриві найбільш швидких молекул, здатних перебороти сили зчеплення, спрямовані усередину рідини, то температура рідини знижується, якщо до неї не підводити теплоту. Цей процес використовується в градирнях для охолодження води, у криогенних установках для одержання усе більш низьких температур. На цьому ж засноване охолодження тіла при виділенні і випару поту в жарку погоду і при випаровуванні води після купання.
Щоб підтримувати температуру рідини, що випаровується, сталою, до неї потрібно підводити теплоту - сховану теплоту паротворення. Визначена в розрахунку на одиницю маси (1 кг), вона називається питомою теплотою паротворення r Дж/кг. Ця величина є характеристичною для кожної речовини окремо, але, крім того, залежить і від температури. Випаровування з поверхні відбувається порівняно повільно. Збільшення кількості теплоти, яка підводиться в одиницю часу, не приводить до помітного збільшення швидкості випаровування, тому що надлишок теплоти йде на збільшення температури рідини.
|
|
|
Випаровування по всьому об’єму рідини в газові пухирці називається кипінням. Кипіння починається в тому випадку, якщо в рідині є мікроскопічні пухирці розчинених газів чи дрібні часточки, а тиск насиченої пари в цих пухирцях досяг зовнішнього (атмосферного) тиску. Пухирці починають збільшуватися в об’ємі, спливають на поверхню і віддають пару в повітря. Швидкість випаровування при кипінні істотно зростає. Уся теплота, яка підводиться, йде на випаровування. Тому температура рідини не зростає, кипіння відбувається при сталій температурі аж до повного випаровування рідини.
Процес переходу молекул пари в рідину називається конденсацією. При цьому виділяється схована теплота конденсації, яка дорівнює схованій теплоті паротворення при тій же температурі.
Експериментально питома теплота паротворення визначається калориметричним шляхом.
|
|
|


