 |
III (областной) этап Всероссийской олимпиады школьников по химии
|
|
|
|
Год 10 КЛАСС
Условия задач
Задача 10–1.
Добавление 20 г образца бесцветного вещества А, дымящего на воздухе, к 100 мл 0,5 М водного раствора гидроксида натрия сопровождается обильным газовыделением (выделяется газ В) и сильным охлаждением реакционной смеси. По окончании видимых изменений смесь остается прозрачной, а раствор при этом содержит лишь 4,2 г соли С. Если полученный раствор прокипятить, а потом упарить в интервале температур 40–90°С, то в качестве сухого остатка может быть выделено 3,1 г соединения D. Соль С можно выделить из раствора без разложения аккуратным упариванием ниже 60°С.
Если 4,2 г соли С или 3,1 г соединения D нагреть в вакууме до 160–200°С, то в обоих случаях образуется 2,65 г соли Е – белого кристаллического гигроскопичного соединения, умеренно растворимого в воде.
Соль Е давно и широко используют в промышленности. Основное количество Е получают так называемым аммиачно-хлоридным способом: естественный или природный рассол NaCl очищают от примесей Са и Mg раствором Е и Са(ОН)2, насыщают NН3, а затем обрабатывают его газом В в барботажных колоннах. В результате такого процесса образуется соль С, прокаливанием которой получают Е.
1. Определите все вещества, зашифрованные в задаче, и приведите уравнения химических превращений, описанных в задаче, включая основное уравнение реакции аммиачно-хлоридного способа (другие уравнения реакций, относящиеся к данному методу синтеза Е, включая очистку рассола от ионов щелочноземельных металлов, писать не следует).
2. Все зашифрованные в задаче вещества имеют тривиальные названия, приведите их.
3. Аммиачно-хлоридный метод синтеза Е имеет и другое название (по имени его первооткрывателя), приведите это название.
|
|
|
Задача 10–2.
Известны различные способы придать неспелым арбузам товарный вид.
Одни пичкают арбузы селитрой, другие шприцуют марганцовкой, третьи помещают в фургоны с недоспелыми арбузами некие капсулы или баллоны с газом этиленом, способствующим быстрому покраснению арбузных внутренностей. Последний метод безопаснее всего, поскольку этилен – природный фитогормон и выделяется, например, гнилыми фруктами, вследствие чего положенные рядом с гнилушками незрелые плоды быстрее созревают.
1. Напишите формулы упомянутых веществ.
2. Напишите в сокращенном ионном виде уравнение реакции между «повышателями товарного вида», если арбуз, обработанный марганцовкой, долгое время лежит рядом с гнилыми плодами. Каков, по Вашему мнению, будет цвет арбузной мякоти при этом?
3. Исходным веществом для получения марганцовки обычно служит природный минерал пиролюзит, из которого предварительно готовят твердый манганат (VI) калия, потом его переводят в раствор и подвергают окислению. Раньше для этой цели использовали хлор или озон.
Современная технология состоит в анодном окислении манганата (VI) калия. Напишите уравнения всех упомянутых реакций получения марганцовки из пиролюзита.
4. Для марганца известен другой минерал – гаусманит, который состоит из атомов тех же двух элементов, что и пиролюзит, но массовая доля марганца в нем в 1,14 раза больше, чем в пиролюзите. Установите состав гаусманита.
Задача 10–3 (автор О. В. Архангельская).
В шести пронумерованных бюксах находятся кристаллические соли бария: сульфат, карбонат, сульфит, ортофосфат, хлорид и перманганат*. Кроме того, в Вашем распоряжении имеются вода и разбавленные соляная и серная кислоты.
1. Как определить, что находится в каждом из бюксов, используя только упомянутые в условии вещества? Ответы обоснуйте (напишите ход Ваших рассуждений при идентификации каждого вещества и уравнения соответствующих реакций). Итог представьте в виде таблицы или схемы.
|
|
|
2. Для чего даны две кислоты? Объясните необходимость использования каждой из кислот в каждом конкретном случае.
Задача 10–4.
Ниже приведены температуры замерзания растворов глюкозы и хлорида натрия в допущении, что эти растворы идеальны.
| Tзам., °С | – 2 | – 3 | – 4 | – 5 | – 6 | – 7 | – 8 | – 9 | – 10 |
| w(NaCl), % | 3,0 | 4,5 | 5,9 | 7,3 | 8,6 | 9,9 | 11,2 | 12,4 | 13,6 |
| w(С6Н12О6), % | 16,2 | 22,5 | 27,9 | 32,6 | 36,7 | 40,4 | 43,6 | 46,6 | 49,2 |
1. Постройте графики зависимости температур замерзания растворов от массовой доли растворенного вещества. Являются ли эти зависимости линейными?
2. Как видно из приведенных данных, при увеличении массы растворенного вещества температура замерзания уменьшается. На этом основано действие многих антигололедных реагентов. Оцените массы хлорида натрия и глюкозы, необходимые для плавления 1 кг льда при температуре – 4,5°С.
3. При температуре – 4,5°С замерзает 8,3%-ный раствор KCl. Сколько моль хлорида калия требуется, чтобы температура плавления 1 кг льда составила –4,5°С?
4. Почему глюкозы требуется больше, чем хлорида натрия для плавления одинаковой массы льда при одной и той же температуре?
Задача 10–5.
Органическое соединение А массой 1,42 г при температуре 250ºС и давлении, равном 1 атмосфере, занимает объем 644,8 мл. Водный раствор того же количества А реагирует с цинком с образованием 168,3 мл водорода (при н. у.). По данным элементного анализа соединение А содержит 25,41% С, 3,198% Н и 33,85% O по массе.
1. Определите молярную массу соединения А.
2. Установите состав вещества А.
3. Изобразите простейшую формулу соединения А.
4. Изобразите истинную формулу вещества А.
5. К какому классу органических соединений относится вещество А? Изобразите его структурную формулу.
6. Подтвердите расчетами принадлежность вещества А к определенному классу.
Всероссийская олимпиада школьников по химии. Региональный этап 2008 - 2009
Класс
Задача 10-1. Основный карбонат некоторого металла М, используемый ранее в качестве пигмента, при нагревании разлагается с частичным окислением до вещества красного цвета К (реакция 1), а в атмосфере сероводорода превращается в соединение черного цвета Ч (реакция 2). При взаимодействии с пероксидом водорода вещество Ч превращается в соединение белого цвета Б (реакция 3).Если порошок вещества Б растворить в избытке щелочи (реакция 4), добавить тиокарбамид и нагреть, то получится соединение Ч, которое осаждается на стенках пробирки в виде зеркала (реакция 5). Вещество Ч растворяется в разбавленной азотной кислоте (реакция 6), а образующиеся при этом ионы металла М дают с раствором иодида калия соединение желтого цвета Ж (реакция 7), растворяющееся в избытке реагента (реакция 8). Осадок Ж растворяется при нагревании в воде, в растворе уксусной кислоты, а при охлаждении раствора из него снова выпадают красивые кристаллы в форме листочков с золотистым блеском (реакция Х). Вещество красного цвета К разлагается разбавленной азотной кислотой с образованием соединения коричневого цвета О (реакция 9), проявляющего свойства сильного окислителя.
|
|
|
1. Определите вещества М, К, Ч, О и приведите их тривиальные названия.
2. Напишите уравнения реакций образования веществ (1 – 9).
3. Как называется реакция Х?
4. Докажите, что вещество О – сильный окислитель (приведите два примера).
5.
Задача 10-2. Лаборант нашел в практикуме 4 склянки с белыми кристаллическими порошками. На склянках было написано «сода». Лаборант обнаружил, что все найденные вещества растворимы в воде. При действии соляной кислоты на пробы твердых веществ в трех из четырех случаев выделяется газ. Лаборант решил измерить объем выделяющихся газов. Для этого он взвесил по 3,0 г каждой соды, растворил каждую навеску в 5,0 мл воды и к каждому раствору медленно прилил по 15,0 мл соляной кислоты (r» 1,05 г/мл). Выделившийся газ был собран при 22°С и 740 мм рт. ст. Результаты опытов представлены в таблице:
| № опыта | V (газа), мл |
- Перечислите названия «сод», которые нашел лаборант.
- Напишите химические формулы каждой соды и напишите их современные названия.
- На основании расчетов (считая, что все реакции прошли количественно, и, пренебрегая растворимостью газа в воде) укажите, какая «сода» была в 1, 2 и 3 опытах соответственно.
- Оцените массовую долю хлороводорода в использованном для опытов растворе.
|
|
|
Задача 10-3. Соединения А–Г состоят из трех элементов и имеют одинаковый качественный состав. Некоторые сведения о них представлены в таблице:
| А | Б | В | Г | |
| Массовое содержание одного и того же элемента, % | 61,4 | 51,5 | 34,7 | 30,0 |
| Температура плавления, ºC | –77 | 300* | 600* | 150* |
| Отношение к воде | Реагирует | Растворяется | Не растворяется | Реагирует |
* - плавление с разложением
Исходным веществом для синтеза соединений А–Г является оранжево-желтый порошок оксида Д. Желтая жидкость А с резким запахом может быть получена пропусканием над Д газообразного хлороводорода в присутствии P2O5 (реакция 1) Соединение Б синтезируют нагреванием А с металлическим цинком (реакция 2), а его водный раствор – взаимодействием Д с концентрированной соляной кислотой при нагревании (реакция 3). Термической диссоциацией Б получают В, при этом также образуется А (реакция 4). Соединение Г оранжево-красного цвета синтезируют пропусканием озона над А (реакция 5).
1) Определите неизвестные вещества и запишите уравнения всех реакций, упоминающихся в условии задачи.
2) Какие продукты образуются при взаимодействии веществ А и Г с водой? Напишите уравнения реакций.
3) Предскажите геометрическое строение частиц вещества А.
4) Как получают в лаборатории соединение Д (напишите уравнение реакции и условия ее проведения)?
Задача 10-4. На российских космических кораблях и станциях, начиная с первого полета Гагарина, используется атмосфера, максимально близкая к земной (содержание кислорода 20 об. %, давление 1 атм). При выходах в открытый космос возникает необходимость восполнения воздушной среды в больших объёмах. Использование для этих целей сжатой газовой смеси в традиционных шар-баллонах ограничено корпусной массой. Рассмотрим возможность химического получения необходимой газовой смеси с использованием термического разложения аммонийных солей. При нагревании нитрита аммония выделяется азот, а при термическом разложении нитрата аммония образуется оксид азота (I), который при более высокой температуре каталитически разлагается на простые вещества. Свойства исходных и конечных веществ приведены в таблице.
| Вещество | NH4NO2 | NH4NO3 | N2O | N2 | O2 | H2O (ж) |
| Df H °298, кДж/моль | –256,1 | –365,4 | 82,0 | –285,8 | ||
| T пл., °С | разл. > 35°С | 169,6 | –91 | –210 | –218,8 | – |
| Т кип., °С | – | разл. > 210 | –88,5 | –195,8 | –183,0 | |
| Плотность, г/см3(тв., ж.) г/л (газ) | 1,69 | 1,72 | 1,978 | 1,251 | 1,429 | 1,00 |
Здесь Df H °298 – стандартная энтальпия образования соединения при температуре 298 К.
|
|
|
1. Напишите уравнения термического разложения нитрата и нитрита аммония, оксида азота (I).
2. В каком соотношении нужно использовать нитрат и нитрит аммония для получения воздушной смеси?
3. Рассчитайте стандартные энтальпии реакций разложения при температуре 25 °С. Определите, являются ли эти процессы экзо- или эндотермическими.
4. Какое давление оказывали бы газообразные продукты разложения нитрата и нитрита аммония, если бы газы находились в объёме, равном объёму соответствующих твёрдых солей при температуре 25 °С?
5. Какая масса нитрата и нитрита аммония потребуется для заполнения воздухом переходного тамбура объёмом 1 м3 при 25 °С?
6. Рассчитайте, сколько теплоты выделится в процессе получения воздушной смеси, необходимой для заполнения переходного тамбура.
7. Укажите причины, которые, на Ваш взгляд, могут ограничивать использование такого метода получения воздушной смеси на космических аппаратах.
Задача 10-5. Приведенные ниже схемы превращений представляют собой важнейшие промышленные процессы с использованием органического соединения А, а также некоторых продуктов, образующихся из А.
1. 

2. 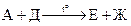
3. 
4. 
5. 
6. 
7. 
8. 
9. B+H  У
У
10. 
Напишите уравнения реакций, соответствующие этим схемам. Примите во внимание, что соединения Б, Д, М, Т – газообразные простые вещества, а З – простое вещество, существующее при комнатной температуре в твердом состоянии, причем атомные массы Д и З отличаются в 2 раза; A, В, Г4, Е, Ж, И-Л, Н, П – бинарные соединения.Кроме того, известно, что в зависимости от соотношения реагентов при взаимодействии А с Д может образовываться (наряду с Ж) также бинарное вещество Л, что обычно является крайне нежелательным процессом. Два разных продукта (отличающихся от А) могут образоваться и при взаимодействии М с Н. Наконец, присоединение Р к Ф дает аддукт, который после отщепления Ж превращается в продукт, являющийся, как и соединение У, важным мономером в синтезе высокомолекулярных соединений.
|
|
|


