 |
Методы оценки иммунного статуса
|
|
|
|
Иммунодефициты. Классификация медицинское значение.
Иммунодефицитными состояниями называют нарушения в
иммунной системе и в способности организма к нормальному иммунному
ответу на антигены и к осуществлению других иммунологических
функций.
В основу классификации иммунодефицитных состояний могут
быть положены разные принципы (табл. 18.1). Прежде всего их подразделяют
на в р о ж д е н н ы е и п р и о б р е т е н н ы е. Первые
часто связаны с генетическим блоком развития иммунной системы в
онтогенезе, с предетерминированным нарушением процессов пролиферации
и дифференциации иммунокомпетентных клеток.
Приобретенные иммунодефицитные состояния возникают вследствие
нарушений иммунорегуляции, связанных с перенесенными
инфекциями, травмами, лечебными воздействиями и другими причинами.
Другой принцип классификации иммунодефицитов связан с
у р о в н е м д е ф е к т а иммунной системы, ее дефектного звена.
Наиболее тяжелыми являются комбинированные дефекты Т- и В-си-
стем иммунитета. Чаще встречаются преимущественные дефекты либо
Иммунодефицитные состояния
при старении
Т-, либо В-системы. Примером врожденного дефекта Т-системы иммунитета
является синдром аплазии тимуса.
Преимущественные дефекты В-системы иммунитета выявляются
как синдромы гипогаммаглобулинемии или агаммаглобулинемии.
Причем снижение уровня иммуноглобулинов в сыворотке крови может
касаться либо всех классов Ig, либо избирательно — одного-двух
классов. Чаще других наблюдается избирательная недостаточность
SIgA, с чем бывают связаны грубые нарушения местной защиты слизистых
оболочек.
Для некоторых иммунодефицитных состояний характерна чрезвычайно
|
|
|
высокая избирательность дефекта. Примером является
СПИД, возбудитель которого — ВИЧ — избирательно поражает и
выводит из строя лишь одну из субпопуляций Т-лимфоцитов — Т-
хелперы. Однако даже такой избирательный дефект отражается как
на клеточных, так и на гуморальных механизмах защиты организма,
так как Т-хелперы являются одной из иммунорегуляторных субпопуляций
Т-лимфоцитов.
Следует учитывать, что один и тот же синдром, например ги-
погаммаглобулинемия, может быть следствием дефекта разных звеньев
иммунной системы. В одном случае причиной может быть
дефект В-лимфоцитов, в других — дефект антиген-представляю-
щих клеток или дефект Т-хелперов.
Третий принцип классификации иммунодефицитных состояний
основан на анализе к о н к р е т н ы х п р и ч и н их возникновения.
Генетически детерминированные иммунодефицитные состояния выявляются
в основном у детей первых месяцев жизни, которые редко
доживают до года без проведения активного лечения с замещением
выявленных дефектов.
Гораздо чаще встречаются у детей и взрослых приобретенные
иммунодефицитные состояния инфекционной природы. Они возникают
вследствие размножения возбудителей непосредственно в клетках
иммунной системы. Персистирующие и размножающиеся в им-
мунокомпетентных клетках вирусы, риккетсии, грибы, простейшие,
бактерии могут вызывать разрушение этих клеток или нарушение их
функций. Например, ВИЧ репродуцируется вТ-хелперах, вирус инфекционного
мононуклеоза Эпштайна-Барр избирательно поражает
В-лимфоциты.
Инфицированные иммунокомпетентные клетки могут разрушаться
под действием самого возбудителя, его компонентов или продуктов
(токсинов, ферментов). Причиной гибели зараженных клеток может
явиться также специфическая иммунная реакция организма, направленная
против микробных антигенов, включенных в клеточную мембрану.
|
|
|
Часто иммунокомпетентные клетки утрачивают определенные
функции или приобретают новые в результате их инфицирования.
Например, наблюдается поликлональная активация В-лимфоцитов
после инфицирования клеток вирусом Эпштайна-Барр (EBV).
Еще более многочисленную группу составляют иммунодефицитные
состояния, которые развиваются вследствие нарушения процессов
иммунорегуляции в ходе перенесенной инфекции. Постинфекци-
онная или поствакцинальная иммуносупрессия может носить как ан-
тигенспецифический, так и антигеннеспецифический характер, чем и
определяется спектр ее иммунопатологических последствий.
Достаточно частой причиной развития вторичных нммунодефи-
цитных состояний являются первичные (врожденные или приобретенные)
метаболические или гормональные дефекты. Дефекты
метаболизма встречаются при диабете, ожирении, атеросклерозе, уремии,
истощении, на фоне которых развиваются вторичные дефекты
иммунокомпетентных клеток.
Нередкой причиной формирования вторичных иммунодефицитных
состояний являются иммунопролиферативные заболевания, а также
применение иммуносупрессирующих воздействий и препаратов с
целью лечения опухолевых или иммунопатологических процессов.
Чаще всего иммунодефицитные состояния приводят к возникновению
оппортунистических инфекций, вызванных условно-патогенными
микроорганизмами, представителями аутохтонной микрофлоры
кожи, слизистых оболочек дыхательных путей или желудочно-
кишечного тракта. На фоне преимущественных дефектов
гуморального иммунитета (В-звена) преобладают бактериальные (стафилококковые,
стрептококковые и др.) инфекции. На фоне преимущественных
дефектов клеточного иммунитета (Т-звена макрофагов)
проявляются в основном вирусные инфекции (герпес, цитомегалови-
русная инфекция и др.), кандидозы, микобактериозы и др.
Иммунодефицитные состояния могут приводить к возникновению
опухолей, о чем свидетельствует необычайно высокая частота
развития саркомы Капоши у больных СПИДом. Это объясняется
дефектом иммунологического противоопухолевого надзора.
Иммунодефицитные состояния могут проявляться также в виде аллергических
|
|
|
и аутоиммунных заболеваний.
Для лабораторной диагностики иммунодефицитных состояний
проводится поэтапная оценка иммунного статуса организма с целью
выявления уровня дефекта и уточнения дефектного звена.
Методы оценки иммунного статуса
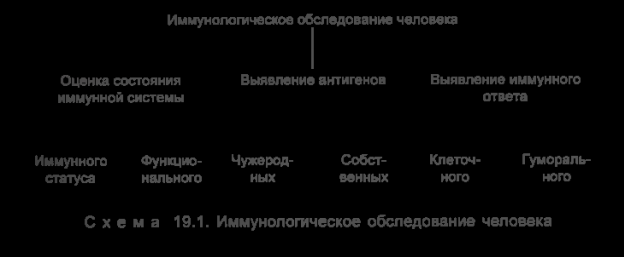
Иммунологическое обследование человека сводится к оценке
состояния иммунной системы (схема 19.1), выявлению чужеродных
или собственных антигенов, обнаружению признаков клеточных
и гуморальных специфических иммунных реакций.
Оценка иммунного статуса организма начинается с ориентировочного
клинического (первого) этапа, на котором врач собирает
и оценивает иммунологический анамнез: частоту инфекционных заболеваний,
характер их течения, выраженность температурной реакции,
наличие очагов хронической инфекции, признаков аллергизации.
Далее оцениваются результаты клинического анализа крови: содержание
гранулоцитов, моноцитов, лимфоцитов. С помощью бактериологических,
вирусологических и серологических исследований выявляется
бактерио- или вирусоносительство.
На втором этапе в иммунологической лаборатории проводится
исследование крови с использованием иммунологических тестов 1-го
и 2-го уровней.
Тесты 1-го уровня позволяют выявить грубые нарушения со стороны
иммунной ситемы путем определения в крови процентного
содержания и абсолютного количества Т -и В-лимфоцитов, уровня
иммуноглобулинов крови, оценки показателей неспецифической защиты
организма.
Для выявления и подсчета Т-и В-лимфоцитов наиболее точными
являются методы, состоящие в выявлении поверхностных маркеров —
антигенов системы CD, которые были рассмотрены в разделе 13.1.
К этим антигенам биопромышленность готовит стандартные моноклональные
антитела и наборы реактивов, позволяющие в имму-
нолюминесцентных и цитотоксических тестах (см. далее) выявить Ти
В-лимфоциты, их субпопуляции, другие клетки иммунной системы.
Так, маркером Т-лимфоцитов служит антиген CD3, В-лимфоцитов —
CD22, хелперных Т-лимфоцитов — CD4, цитотоксических лимфоцитов
|
|
|
— CD8, естественных киллеров — CD 16, CD56.
Т- и В лимфоциты выявляют также по их способности фиксировать
на своей поверхности эритроциты барана или мыши, образуя
видимые под микроскопом структуры, именуемые розетками
(см. рис. 13.4). В-лимфоциты, обладающие рецепторами для иммуноглобулина
G и комплемента могут быть выявлены также по способности
формировать розетки с эритроцитами, нагруженными
этими белками. Содержание в крови здорового взрослого человека
Т-клеток — 4 0-70%, В-лимфоцитов — 10-30% общего числа лимфоцитов.
Некоторые лимфоциты (около 5%) не имеют маркеров Тили
В-клеток. Это нулевые лимфоциты, утратившие рецепторы. Их
число возрастает при некоторых заболеваниях.
Кроме того, к тестам 1-го уровня относится определение концентрации
сывороточных иммуноглобулинов IgM, IgG и IgA. Для
этого используются антисыворотки к тяжелым цепям иммуноглобулинов
разных классов, реакция преципитации (тест иммунодиффузии
— см. 19.2) или нефелометрия и турбидометрия, выявляющие
взаимодействие иммуноглобулина с антителами по светорассеянию
или мутности. Уровень сывороточных иммуноглобулинов отражает
функциональное состояние В-системы иммунитета.
Для оценки факторов неспецифической защиты организма определяют
фагоцитарную активность лейкоцитов крови. О фагоцитарной
активности судят по способности клеток к фагоцитозу нейтральных
частиц латекса, эритроцитов или микробных клеток. При этом
вычисляют процент фагоцитирующих клеток (фагоцитарное число) и
среднее число частиц поглощенных одним фагоцитом (фагоцитарный
индекс).
Тесты 2-го уровня позволяют провести более тщательный анализ
для уточнения характера дефекта, выявленного на предыдущем этапе
с помощью ориентировочных тестов. К ним относится определение
субпопуляций Т-лимфоцитов (CD4+ и CD8+), их соотношений, оценка
их функциональной активности, супрессорного потенциала, анализ
цитокинов и их рецепторов. Функциональная активность лимфоцитов
может быть оценена по количеству бластных форм, нарастающих
после активации клеток.
Потенциальную способность лимфоцитов к активации оценивают
после стимуляции митогенами, фитогемагглютином и др., культивируемых
вне организма клеток. Количество бластных форм может
быть определено при микроскопии. Более точен и чувствителен радиометрический
метод, оценивающий интенсивность включения радиоактивных
предшественников (тимидина) в ДНК культивируемых
клеток. Для оценки иммунной защиты слизистых используется определение
секреторных иммуноглобулинов IgA.
Уровень активности фагоцитов оценивают по их способности к
|
|
|
ферментативной обработке поглощенных клеток. Наиболее распространен
так называемый НСТ-тест, основанный на выявлении способности
клеток восстанавливать бесцветный реактив нитросиний тетразоль
в краситель, окрашивающий активную клетку в синий цвет.
|
|
|


