 |
Експериментальна частина. 1. Приготування робочого розчину соляної кислоти. 2. Приготування стандартного розчину тетраборату натрію
|
|
|
|
Експериментальна частина
1. Приготування робочого розчину соляної кислоти
За допомогою ареометра визначіть густину концентрованої соляної кислоти. Наприклад, виявилось, що густина становить
1, 19 г/см3. За таблицею знайдіть масову частку HCl у цьому розчині. Для наведеного прикладу вона дорівнює 38%. Визначимо кількість цієї кислоти для приготування, наприклад, 500 мл 0, 1 н. розчину соляної кислоти. Знаючи, що молярна маса еквіваленту HCl дорівнює 36, 46 г/моль, знайдемо масу HCl:
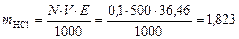 г.
г.
Розв¢ язуючи пропорцію
100 г розчину містять 36 г HCl
Х г розчину містять 1, 823 г,
знаходимо потрібну масу розчину концентрованої соляної кислоти:
 г.
г.
Проте зважувати таку летку речовину, якою є соляна кислота, незручно, тому необхідно перерахувати її масу на об¢ єм:
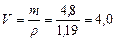 мл.
мл.
Відміряйте знайдений об¢ єм концентрованої соляної кислоти за допомогою бюретки або невеликої мензурки і додайте дистильовану воду до 500 мл. Не забудьте ретельно перемішати одержаний розчин.
2. Приготування стандартного розчину тетраборату натрію
Вихідною речовиною, найзручнішою для встановлення точної концентрації соляної кислоти, є тетраборат натрію Na2B4O7× 10H2O (бура). Водний розчин його має, завдяки гідролізу, лужну реакцію:
Na2B4O7 + 7H2O = 2NaOH + 4H3BO3.
Бура погано розчиняється у холодній воді, тому до наважки у склянку приливайте гарячу дистильовану воду порціями, кожного разу перемішуючи скляною паличкою і переносячи розчин у мірну колбу місткістю 250 мл. Після повного розчинення дайте розчину охолонути, потім об¢ єм його доведіть до риски мірної колби і ретельно перемішайте.
|
|
|
3. Встановлення нормальності розчину соляної кислоти за тетраборатом натрію
Ретельно вимиту бюретку сполосніть невеликими порціями робочого розчину соляної кислоти з метою видалення залишків води. Користуючись лійкою, заповніть бюретку соляною кислотою, включаючи і нижню її частину, витиснувши з неї бульбашки повітря. Потім зніміть лійку і встановіть нижній край меніску на нульовій поділці.
За допомогою чистої піпетки відберіть аліквотну частину розчину тетраборату натрію і перенесіть її у конічну колбу для титрування. Додайте у колбу 2–3 краплини метилоранжу.
Під колбу з розчином підкладіть листок білого паперу і приступайте до титрування. У точці еквівалентності спостерігається перехід забарвлення з жовтого у рожевий. Кількість титрувань повинна бути такою, щоб різниця між трьома результатами не перевищувала 0, 1 мл.
З цих вимірів візьміть середнє арифметичне і підрахуйте нормальність розчину соляної кислоти.
Приклад: на титрування 25 мл 0, 1 н. розчину тетраборату натрію використано соляної кислоти:
V1 = 24, 5 мл, V2 = 24, 3 мл, V3 = 24, 4 мл
отже
VHCl =  мл,
мл,
тоді
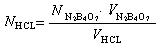 = 0, 102 моль/л.
= 0, 102 моль/л.
Методики взяття наважок, приготування розчинів, титрування, проведення вимірів і розрахунків, які описані у даній роботі, є типовими і застосовуються в інших титрометричних визначеннях.
Лабораторна робота 5
Визначення вмісту соди,
карбонатної твердостІ води
і кислотності рідких палив
Завдання для домашньої підготовки
Сутність методу нейтралізації (кислотно-основного титрування). Встановлення точки еквівалентності. Теорія кислотно-основних індикаторів. Інтервал переходу індикатора і показник титрування. Зв¢ язок між константою дисоціації індикатора та інтервалом зміни його забарвлення. Графічний метод зображення процесу нейтралізації. Розрахунок рН сильних і слабких кислот та основ. Криві титрування і вибір індикатора для кожного випадку титрування.
|
|
|
Можливості методу нейтралізації. Методика визначення соди.
Твердість води та ії різновиди. Методика визначення карбонатної твердості води.
Методика визначення кислотності рідких палив.
|
|
|


