 |
17.11.2 Классификация кристаллов
|
|
|
|
17. 11. 2 Классификация кристаллов
Кристаллическая решетка может обладать различными видами симметрии. Под симметрией кристаллической решетки понимается свойство решетки совпадать сама с собой при некоторых пространственных перемещениях.
Всякая решетка, прежде всего, обладает трансляционной симметрией, т. е. совпадает сама с собой при перемещении (трансляции) на величину периода идентичности. Из других видов симметрии отметим симметрию по отношению к поворотам вокруг некоторых осей, а также к зеркальному отражению к поворотам вокруг некоторых осей, а также к зеркальному отражению относительно определенных плоскостей. Если решетка совпадает сама с собой n раз при полном повороте, т. е. совпадение происходит при повороте на угол 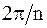 , то эта ось называется осью n - го порядка симметрии. Примеры структур, обладающие такими осями симметрии, показаны на рис. 17. 15.
, то эта ось называется осью n - го порядка симметрии. Примеры структур, обладающие такими осями симметрии, показаны на рис. 17. 15.
 Доказано, что кроме тривиальной оси 1-го порядка, возможны только оси 2-го, 3-го, 4-го и 6-го порядка. На рисунке, демонстрирующем эти структуры, белыми кружками, черным кружками и крестиками обозначены атомы разных сортов.
Доказано, что кроме тривиальной оси 1-го порядка, возможны только оси 2-го, 3-го, 4-го и 6-го порядка. На рисунке, демонстрирующем эти структуры, белыми кружками, черным кружками и крестиками обозначены атомы разных сортов.
Плоскости, при зеркальном отражении от которых решетка совпадает сама с собой, называются плоскостями симметрии. По форме элементарной ячейки все кристаллы делятся на семь кристаллографических систем (сингонии). В порядке возрастания симметрии сингонии располагаются следующим образом:
1 Триклинная система. Для неё характерно, что a ≠ b ≠ c, α ≠ β ≠ γ. Элементарная ячейка имеет форму косоугольного параллелепипеда.
2. Моноклинная система. Два угла – прямые, третий (β ) отличен от прямого, т. е. a ≠ b ≠ c; γ = α = 90 ˚; β ≠ 90 ˚. Элементарная ячейка имеет форму прямой призмы, в основании которой лежит параллелограмм (т. е. форму прямого параллелепипеда).
|
|
|
3. Ромбическая система. Все углы прямые, все ребра разные: a ≠ b ≠ c; α = γ = β = 90˚. Элементарная ячейка имеет форму прямоугольного параллелепипеда.
4. Тетрагональная система. Все углы – прямые, два ребра одинаковые: a = b ≠ c; α = γ = β = 90˚ . Элементарная ячейка имеет форму прямой призмы с квадратным основанием.
5. Тригональная система. Все ребра – одинаковые, все углы также одинаковые и отличные от прямого: a = b = c; α = γ = β ≠ 90˚.
 6. Гексагональная система. Ребра и углы между ними удовлетворяют условиям: a = b ≠ c; α = β = 90˚, γ = 120˚. Если составить вместе три элементарные ячейки, как показано на рис. 17. 16, то получается правильная шестигранная призма.
6. Гексагональная система. Ребра и углы между ними удовлетворяют условиям: a = b ≠ c; α = β = 90˚, γ = 120˚. Если составить вместе три элементарные ячейки, как показано на рис. 17. 16, то получается правильная шестигранная призма.
7. Кубическая система. Все ребра – одинаковые, все углы - прямые: a = b = c; α =γ =β =90˚. Элементарная ячейка имеет форму куба.
17. 11. 3 Физические типы кристаллических решеток
В зависимости от природы частиц, помещающихся в узлах кристаллической решетки, и от характера сил взаимодействия между ними различаются четыре типа кристаллических решеток (четыре типа кристаллов): ионные, атомные, металлические и молекулярные.
1. Ионные кристаллы. В узлах кристаллической решетки помещаются ионы разных знаков. Силы взаимодействия между ними являются в основном электрическим (кулоновскими). Связь, обусловленная электрическими силами притяжения между разноименно заряженными ионами, называется гетерополярной или ионной.
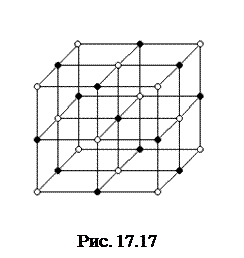 Типичным примером ионной решетки, может служить, изображенная на рис. 17. 17, решетка поваренной соли NaCl. Эта решетка принадлежит к кубической системе. Белыми кружками изображены несущие положительный заряд ионы натрия, черными кружками – отрицательные ионы хлора. Ионный кристалл состоит не из молекул, а из ионов. Весь кристалл в целом можно рассматривать как одну гигантскую молекулу.
Типичным примером ионной решетки, может служить, изображенная на рис. 17. 17, решетка поваренной соли NaCl. Эта решетка принадлежит к кубической системе. Белыми кружками изображены несущие положительный заряд ионы натрия, черными кружками – отрицательные ионы хлора. Ионный кристалл состоит не из молекул, а из ионов. Весь кристалл в целом можно рассматривать как одну гигантскую молекулу.
|
|
|
2. Атомные кристаллы. В узлах кристаллической решетки помещаются нейтральные атомы. Связь частиц в таких кристаллах называется ковалентной. Силы взаимодействия между частицами имеют также электрический, но не кулоновский механизм. Эта связь осуществляется электронными парами. Ковалентная связь может осуществляться только валентными, т. е. наименее связанными с атомом электронами. Поскольку каждый электрон каждый электрон может обеспечить связь только с одним атомом, число связей, в которых может участвовать данный атом равно его валентности.
 Типичными примерами атомных кристаллов могут служить полупроводники – германий Ge и кремний Si. Для этой решетки характерно то, что каждый атом окружен четырьмя равноотстоящими от него соседями (рис. 17. 18), расположенными в вершинах правильного тетраэдра.
Типичными примерами атомных кристаллов могут служить полупроводники – германий Ge и кремний Si. Для этой решетки характерно то, что каждый атом окружен четырьмя равноотстоящими от него соседями (рис. 17. 18), расположенными в вершинах правильного тетраэдра.
Каждый из четырех валентных электронов входит в электронную пару, связывающую данный атом с одним из соседей.
3. Металлические кристаллы. Во всех узлах кристаллической решетки расположены положительные ионы металла. Между ними беспорядочно движутся электроны (электронный газ), отщепившиеся от атомов при образовании ионов. Эти электроны играют роль «цементирующего материала», не давая разлететься положительным ионам. В противном случае решетка распалась бы под действием сил отталкивания между ионами.
4. Молекулярные кристаллы. В узлах кристаллической решетки помещаются определенным образом ориентированные молекулы. В данном случае силы связи между частицами – это вандерваальсовы силы притяжения между молекулами, которые учитывались нами при получении уравнения состояния реальных газов. Молекулярные решетки образуют, например, следующие вещества: 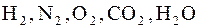 . Таким образом, обычный лед, а также так называемый сухой лед /твердая углекислота/ представляют собой молекулярные кристаллы.
. Таким образом, обычный лед, а также так называемый сухой лед /твердая углекислота/ представляют собой молекулярные кристаллы.
|
|
|


