 |
Средняя кинетическая энергия хаотичного поступательного движения молекул газа пропорциональна абсолютной температуре
|
|
|
|
Изопроцессы идеального газа
Изопроцессы идеального газа – процессы, при которых один из параметров остаётся неизменным.
Изохорический процесс. Закон Шарля. V = const.
При постоянном объёме и неизменных значениях массы газа и его молярной массы, отношение давления газа к его абсолютной температуре остаётся постоянным: P/Т = const.


Изобарический процесс. Закон Гей-Люссака. Р = const.
При постоянном давлении и неизменных значениях массы и газа и его молярной массы, отношение объёма газа к его абсолютной температуре остаётся постоянным: V/T = const.

:
 . .
| ) |
Изотермический процесс. Закон Бойля – Мариотта. T = const.
При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const. 

Адиабатический процесс – термодинамический процесс, происходящий без теплообмена с окружающей средой.
Уравнение состояния идеального газа
 Идеальный газ - газ, молекулы которого пренебрежимо малы, по сравнению расстояния между ними, и не взаимодействуют друг с другом на расстоянии.
Идеальный газ - газ, молекулы которого пренебрежимо малы, по сравнению расстояния между ними, и не взаимодействуют друг с другом на расстоянии.
МЕНДЕЛЕЕВ объединил известные законы Бойля-Мариотта, Гей – Люсака и Шарля с законом Авогадро
10.первое начало термодинамики. Внутренняя энергия и теплоемкость идеального газа.
Первое начало термодинамики утверждает, что теплота, полученная системой, идёт на увеличение внутренней энергии системы и на совершение этой системой работы, что можно записать как δQ = δA + dU. Здесь dU — полный дифференциал внутренней энергии системы, δQ — элементарное количество теплоты, переданное системе, а δA — бесконечно малая или элементарная работа, совершённая системой..
|
|
|
Внутренняя энергия.Теплоемкость
U=Q-A. изменение внутренней энергии тела равно разности сообщаемой телу теплоты и произведенным телом работы
dQ=dU+dA Это есть первое начало термодинамики или закон сохранения энергии в термодинамики.
Q=U=A количество теплоты,сообщаемой телу идет на увеличение внутренней энергии и на совершение телом работы.
Теплоемоксть
 Теплоёмкость тела характеризуется количеством теплоты, необходимой для нагревания этого тела на один градус
Теплоёмкость тела характеризуется количеством теплоты, необходимой для нагревания этого тела на один градус
Теплоёмкость термодинамической системы зависит от того, как изменяется состояние системы при нагревании.
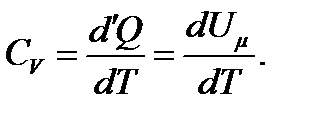 Пусть мы нагреваем один моль идеального газа при постоянном объёме, то первое начало термодинамики: d ' Q = dU (d ' А = 0)
Пусть мы нагреваем один моль идеального газа при постоянном объёме, то первое начало термодинамики: d ' Q = dU (d ' А = 0)
Адиабатический процесс иделаьного газа.Политропичесикие процессы
Процесс, протекающий без обмена энергий с внешней средой – адиабатический

где  — его объём,
— его объём,  — показатель адиабаты,
— показатель адиабаты,  и
и  — теплоёмкости газа соответственно при постоянном давлении и постоянном объёме.
— теплоёмкости газа соответственно при постоянном давлении и постоянном объёме.

В переменных TV имеем  Из уравнения следует, что при адиабатическом расширении идеальный газ охлаждается, а при сжатии нагревается.
Из уравнения следует, что при адиабатическом расширении идеальный газ охлаждается, а при сжатии нагревается.

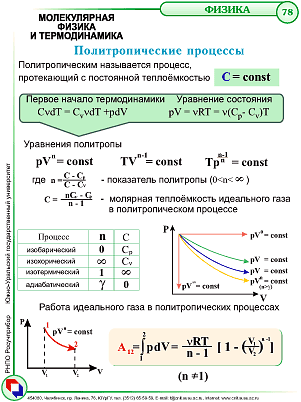
Работа идеального газа в изопроцессах.
Работа А не определяется знанием начального и конечного состояния системы. Её значение зависит от способа («пути») перехода из начального в конечное состояние.



14. Характер теплового движения. Средняя энергия молекул
 Средняя энергия молекул
Средняя энергия молекул
Распределение Максвелла
Распределение Максвелла – это распределение молекул по кинетической энергии.
Распределение Максвелла описывает распределение молекул по скоростям:
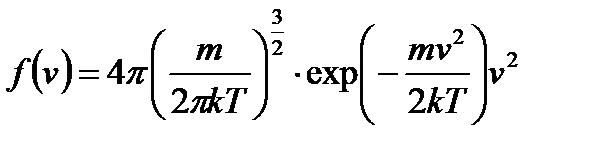
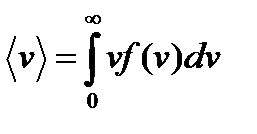




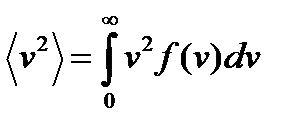

 средняя квадратичная скорость
средняя квадратичная скорость
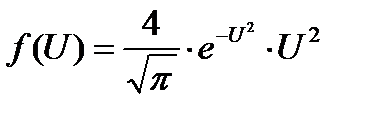 Это уравнение универсальное. В таком виде функция распределения не зависит ни от рода газа, ни от температуры
Это уравнение универсальное. В таком виде функция распределения не зависит ни от рода газа, ни от температуры
Барометрическая формула. Распределение Больцмана..
|
|
|
|
|
|


