 |
7. хімічне осадження з газової (парової) фази
|
|
|
|
При газофазному осадженні покриття утворюються в результаті хімічних реакцій поблизу від поверхні, на поверхні чи в приповерхневому шарі основи. Газофазне осадження здійснюють термічним розкладанням, відновленням, гідролізом, високотемпературним прямим окисленням.
При термічному розкладанні основу нагрівають до температури розпаду газоподібних робочих сполук з осадженням їх нелетких компонентів на поверхню основи. Процес здійснюється у вакуумі 1-10-1 Па, а також в нейтральному чи іншому підібраному середовищі газів-носіїв.
Осадження простих речовин проходить за реакціями:
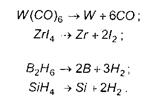
Осадження оксидів:
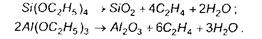
Осадження боридів:

Температури розкладання для різних реакцій коливаються в широких межах: від 300 °С до 2300 °С і вище.
Леткі сполуки відновлюються воднем, аміаком та іншими речовинами, які містять водень, а також парами металів.
Осадження простих речовин:

Осадження сполук (карбідів, боридів, нітридів, силіцидів і оксидів):


де Г - галоген.
Пари металів (К, Nа, Мg, Zn, Сd) осаджуються аналогічним шляхом. Наприклад:
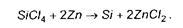
Гідроліз газоподібних галогенідів водним паром (Н2О) чи паром (Н2+СО2) використовується для отримання покриттів оксидів. У першому випадку водяний пар вводиться у систему безпосередньо, а в другому - утворюється за реакцією:

Осадження оксидів:
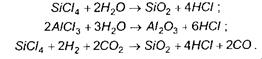
Високотемпературне пряме окислення киснем газоподібних галогенідів чи металоорганічних безкисневих сполук використовується для отримання покриттів оксидів:
|
|
|

Аналогічним шляхом осаджується більшість інших елементів (Fе, Nі, Вe, Аl, Cr, Ті, Нf, Тh, V, Nb, Мо, Та) і їх боридів, нітридів, карбідів і оксидів.
Газофазне нанесення покриттів можна умовно подати як послідовність елементарних процесів:
1) хімічне випаровування, пов'язане з отриманням металомістких сполук;
2) перенесення газоподібної металомісткої речовини;
3) взаємодія газоподібної металомісткої речовини з поверхнею основи;
4) формування покриття.
Процес хімічного випаровування базується на зміні вільної енергії при утворенні леткої сполуки металу, на відміну від термічного випаровування чи катодного розпилення, особливістю котрих є передача кінетичної енергії, яка необхідна для випаровування чи розпилення. Тому хімічне випаровування може здійснюватися при більш низьких температурах з економією енергії.
Реакції " газ - тверде тіло" можна поділити на дві категорії. До першої категорії належать випадки утворення нелеткого продукту, котрий по мірі проходження реакції створює шар на поверхні. Це більшість реакцій окислення.
До другої - належать випадки, коли продукт реакції леткий, і реакція йде на поверхні, чистій від цього продукту. До цієї категорії можна віднести реакції взаємодії металу з галогенами, оксидом вуглецю (СО) та іншими речовинами, які дають металомісткі сполуки.
Схема випаровування металу в результаті реакції з галогеном наведена на рис. 7. 1.
З кінетичної теорії газів відомо, що підвищення температури металу приводить до зменшення концентрації адсорбованих атомів (наприклад, галогену), а підвищення тиску в газовій фазі приводить до її зростання. При хімічному випаровуванні можливі два найбільш важливих випадки:

Рис. 7. 1. Схема хімічного випаровування металу:
1 - газова фаза; 2 - адсорбований шар; 3 - метал, який випаровується;
|
|
|
Рг - тиск галогену в газовій фазі; Nг, - концентрація галогену в адсорбованому шарі;
Nм - концентрація адсорбованих на поверхні атомів металу; Nмг - концентрація адсорбованого галогеніду металу; Рмг - тиск галоген іду металу в газовій фазі;
w1 - швидкість адсорбції атомів галогену; w2 – швидкість переходу атомів металу в адсорбований стан; w3 - швидкість утворення галогеніду металу; w4 - швидкість десорбції галогеніду металу
1) швидкість визначається адсорбцією галогену. Припустимо, що початкові швидкості w2, w3, w4 великі порівняно з w1. Тоді швидкість сумарної реакції буде пропорційна концентрації галогену, адсорбованого на поверхню. Оскільки швидкості інших процесів високі, галоген буде реагувати незабаром після адсорбції. Отже, концентрація адсорбованого галогену ніколи не буде досить великою;
2) швидкість визначається виходом атомів металу з ґратки в положення адсорбції, сприятливе для проходження реакції. Припустимо, що початкові швидкості w1, w3, w4 вище, ніж w2. Якщо галоген сильно адсорбується, високе значення w1 приводить до того, що при тиску вище від мінімального, необхідного для насичення, майже всі доступні місця адсорбції будуть зайняті. Коли атом чи молекула галогену віддаляється від поверхні шляхом реакції з металом, звільнене місце одразу займає частинка з газової фази. Отже, доти, доки тиск галогену вище від певного мінімального значення, швидкість реакції не залежатиме від тиску.
Спрощену модель перенесення металомісткої речовини до поверхні і перенесення продуктів реакції від поверхні наведено на рис. 5. 2.

Рис. 7. 2. Схема перенесення металомісткої речовини до поверхні,
яку покривають:
1 - основа; 2 - покриття; 3 - граничний шар; 4 - вільний потік; δ д- товщина дифузного граничного шару; ХА, Х′ А- мольні частки реагенту А в потоці і на поверхні розподілу; ХR, Х′ R - мольні частки продуктів реакції в потоці і на поверхні розподілу
Товщина дифузійного граничного шару може змінюватися не тільки за часом, але й за відстанню, що ілюструється поступовим розширенням ліній потоку в нижній частині (рис. 7. 2). Швидкість сумарного процесу газофазного осадження, яка виражена через мольні частки компонентів у потоці:
|
|
|
 , (7. 1)
, (7. 1)
де КS і КR - відповідно константи швидкості і рівноваги реакції; Кд -коефіцієнт масопередачі; р - повний тиск; ХА - мольна частка компонента А у потоці; хR - мольна частка газоподібного продукту R у потоці.
Залежно від значень Кд відносно до добутку КSр процес лімітується кінетикою чи дифузією. Якщо Кд > КSр, процес лімітується кінетикою, якщо навпаки, - дифузією. За відсутності термодинамічних обмежень процес осадження з газової фази виявляє схильність до дифузійного обмеження при високих температурах і до кінетичного обмеження при низьких температурах. Зміни лімітуючого механізму можна досягти, змінюючи тиск при постійній температурі. При низьких тисках лімітуючою може бути стадія реакції, а при підвищених - дифузійна стадія.
Хімічне осадження з газової фази за своєю природою є багатокомпонентним. При перевищенні критичного розміру зародок у процесі росту стає кристалом. Ріст кристала газофазного покриття містить послідовну адсорбцію і термічну дисоціацію молекули металомісткого газу на грані з малими індексами, поверхневу дифузію, зв'язок зі сходинкою, його дифузію вздовж сходинки й остаточне приєднання атома металу до кристала покриття.
СVD-процеси давно використовувались у промисловості для екстракції і пірометалургії, а також для отримання порошків з металів, які важко обробляються, наприклад, вольфраму WF6+ЗН2=W+6НF.
Новий підхід до використання цих процесів від вилучення або отримання речовини, до її осадження на поверхню перетворив цей процес у метод отримання нових матеріалів покриття з підвищеним опором спрацьовуванню, ерозії, корозії, добрими характеристиками опору термоудару, поглинання нейтронів тощо.
Процес осадження з парової фази визначається як термодинамічний процес. Основні технологічні параметри, якими можна керувати процесом - тиск, температура, масопереніс, динаміка та активність у системах покриття-основа та пара-газ.
|
|
|
Процес проводиться при тиску від значно нижчих, ніж атмосфера до високих. Необхідно контролювати тиск у реакторі, тиск реагентів, що
вводяться до реактору і тиск продукту, що виводиться з реактору. Температура змінюється по декількох зонах реактора СVD.
Процес осадження з парової фази підкоряється ряду обмежень. Наприклад, він залежить від тиску можливих реакцій та мінімальної температури основи, яку необхідно підтримувати.
Методом СVD можна отримати широку гаму металічного та органічного покриття. Наприклад, з таких добре відомих елементів, що осаджуються як нікель, титан, компонентів, подібних вольфраму, вольфрамо-ренієвим сплавам. Відомі процеси осадження кремнію, вуглецю, бору, танталу, що виділяються з пари або піролітичного вуглецю; диоксиду, нітриду та карбіду кремнію.
Процес СVD має перспективу для нанесення керамічного покриття на композиційні матеріали.
Конструкція реактора для процесів хімічного осадження з парової фази визначається його призначенням. У залежності від того, в якому вигляді знаходиться реагент - газоподібному, твердому або рідинному, та який продукт утворюється після реакції, існує дуже багато конструктивних варіантів установок для нанесення покриття хімічним осадженням з парової фази. Однак всі вони, як правило, мають такі складові:
- система подачі реагентів;
- система охолодження;
- система видалення або повторного використання реагентів (продуктів) та вакуумування камери.
У самому загальному вигляді схема установки та деякі різновиди реакторів представлені на рис. 7. 3, 7. 4.
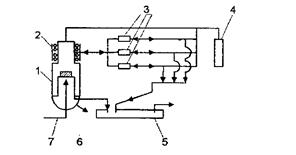
Рис. 7. 3. Загальна схема установки для проведення процесу
хімічного осадження з парової фази:
1 - камера осадження; 2 - змішувальна камера; 3 - печі з реагентами
у хімічній формі, що переносяться газом-носієм; 4 - газ-носій;
5 - пастки; 6 - стік; 7 - подача охолоджуючої рідини
При виборі або конструюванні обладнання та пристосувань для методу осадження покриття з парової фази необхідно враховувати форму і стан реагенту, спосіб нагрівання та розташування підложки у реакторі.
В установках для осадження покриття із парової (газової), фази нагрівання може відбуватися:
1) прямим контактом з джерелом теплоти;
2)безпосередньо;
3) індукційним способом (холодна стінка);
4) радіаційним способом (гаряча стінка).
Реакції СVD можуть бути й екзотермічними, хоч більшість їх ендотермічні, що впливає на охолодження підложки. Це, а також конвективне охолодження реактивними газами потрібно враховувати при виборі способу нагрівання.

Рис. 7. 4. Загальні схеми реакторів для процесів СVD:
а) резестивне нагрівання; 6) індуктивне нагрівання.
|
|
|
1 - підложка; 2 - вхід газів-реагентів; 3 - нагріваючі елементи; 4 – камера
(вакуумна); 5 - датчики температури; 6 - видалення продуктів реакції
або вакуумування
При проектуванні пристосувань у реакційній камері треба враховувати, щоб розташування основи було конструктивно вибрано таким чином, щоб забезпечити ламінарний потік реактивного газу. Важливою системою установок для хімічного осадження з парової фази є термічний контроль і зв'язки між системою продукт-реагент та основою.
Безпека та економічність роботи - два основних фактори, що визначають конструкцію системи видалення та повторного використання газів. Конденсати повинні бути зібрані, їх токсичні та корозійно-нестійкі компоненти повинні бути знешкоджені хімічним або фізичним шляхом. Легкозаймисті речовини повинні бути спалені, розчинені або абсорбовані.
Для хімічного осадження з парової фази можна використовувати газоподібні матеріали, твердофазні реагенти та рідинні компоненти. Газоподібні реагенти можуть бути підведені кожний окремо або попередньо змішані у ємностях. Витрати їх можуть бути проконтрольовані за допомогою датчиків тиску або витратомірами, гази повинні у достатній мірі бути осушені, зневоложені та в потрібній мірі розбавлені нейтральними газами для контролю їх парціального тиску. Щоб не було термічної сегрегації газів з різними щільностями, повинна підтримуватись висока швидкість газового потоку (більше 60 мл/хв). Необхідно проводити контроль якості (чистоти) реагентів.
Твердофазні реагенти повинні витримуватись при температурі реакції з оптимальною експозицією відповідної площі поверхні. Таким чином, форма, в якій вони використовуються, суттєва. Реагент однієї і тієї ж маси буде мати більшу площу поверхні, якщо його форму змінити у такій послідовності: твердий кусень, таблетка, губка, волокно, порошок. Спікання речовини у вигляді порошку зменшує ефективну площу поверхні.
Реагенти в рідинній формі повинні випаровуватись та додаватись у нейтральні носії або газоподібні реагенти необхідної концентрації. Парціальний тиск можна контролювати по об'єму та швидкості газу-носія, тиску пари рідинного реагенту та температурі.
Процеси хімічного осадження покриття відбуваються за рахунок хімічних реакцій. При цьому необхідно враховувати:
- термодинаміку системи, яка може бути провідним фактором хімічної реакції;
- основний хімічний механізм процесу, який визначає швидкість реакції- кінетику процесу;
- характер тепла та масопереносу, на який впливають тип реактору, розмір підложки і конструкція системи.
За допомогою процесів хімічного осадження з парової фази можна отримати покриття як з чистих металів, так і хімічних сполук. Нижче наведені приклади отримання покриття з металів та сполук.
Алюмінієве покриття на нікелевій підложці, розігрітій до 700-1000 °С, можна отримати у реакторі з гарячою стінкою, використовуючи реагентну суміш АlСl3-Н2, нагріту до 130 °С, пропускаючи її над порошковою сумішшю Аl/Аl2О3 (3: 1).
Хромове покриття можна отримати на нікелевій підложці у реакторі з гарячими стінками при 950-1050 °С. Для цього використовується реагент NН4Сl з газом-носієм Н2 при витратах 300 мл/хв. Підтримується температура 180-280 °С. Газова суміш проходить над сумішшю Cr та Аl2О3 (80: 20% вагових). При цьому відбувається дисоціація NН4Сl, CrСl2 завдяки реакції HСl/Cr. Потім CrСl2 реагує з Nі і при відсутності водню відбувається легування поверхні хромом з утворенням Nі-Cr. Існують технології нанесення титанового покриття на внутрішні поверхні довгомірних труб діаметром 10 мм з використанням реагентів ТiСІ4-N2-Н2 з аргоном в якості газа-носія.
За допомогою процесів СVD можна наносити покриття з таких матеріалів як Мо, Та, В та інші. Метод СVD дає можливість отримати чисті матеріали з високою щільністю, але міцність яких знижена завдяки тому, що продукти процесів СVD можуть мати великі стовбчасті зерна і деяку долю аморфної фази, яка повільно перетворюється у кристалічну з більш високою щільністю і утворюють внутрішні напруження.
Методами осадження з парової фази можна отримати такі з'єднання як ТіС, ТiN, ВN, SіС, Si3N4 та інші.
Так, карбід титану осаджували на карбід вольфраму при температурі 850-950 °С, використовуючи пропан, і в більшому температурному інтервалі при зниженому навколишньому тиску. При отриманні нітриду титану як реагенти використовують ТіСl4, N2, Н2. Мікротвердість нітриду титану, яка дорівнює 1600-2000 НV досягається за допомогою процесів СVD в ультразвуковому полі.
При осадженні на залізну підложку має місце двох стадійний механізм. Утворення FеСl2 при температурах нижче 960 °С веде до утворення ізотропного нітриду титану, а наявність Н2 при температурах вище 960 °С викликає утворення анізотропного нітриду титану.
Такі ж самі реагенти використовувались для нанесення покриття на внутрішню поверхню сталевих труб діаметром 10 мм при температурі 1050 °С з використанням пересувної печі.
Наведені приклади характеризують широкі можливості використання процесів хімічного осадження з парової фази для нанесення покриттів, враховуючи необмеженість характеристик процесу і можливість корегування будь-якої газової системи.
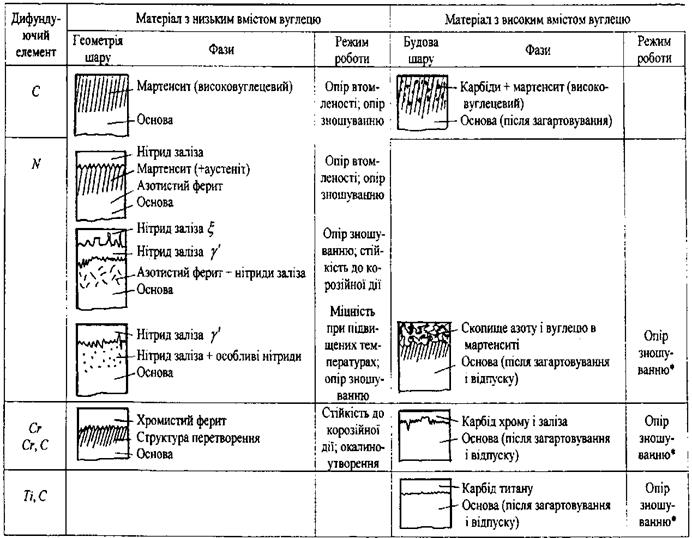
Властивості газофазних покриттів визначаються, насамперед, завдяки отриманню поверхневого шару на основному металі якомога більшим економним легуванням. Для умов спрацьовування на зношування можуть бути отримані мартенситні поверхневі шари, які складаються з нітридів чи карбідів. При збагаченні низьковуглецевої сталі хромом досягається стійкість проти корозії й окалиностійкість. При газовому азотуванні, як і цементації, можна отримати тверді поверхневі зносостійкі шари, що мають високий опір втомленості. На маловуглецевих сталях можна отримати корозійностійкий шар хрому, а на матеріалах з більш високим вмістом вуглецю - зносостійкий шар карбідів хрому.
Структуру і відповідні властивості найбільш поширених газофазних покриттів наведено в табл. 7. 1.
Таблиця 7. 1. Структура і властивості деяких поверхневих шарів на сталі
|
|
|


