 |
Задание для второй команды.
|
|
|
|
Глава 3. Методические разработки по теме: Урок по теме: «Строение атома. Химическая связь»
Цели:
· обобщить и повторить знания учащихся по данной теме;
· выявить степень усвоения материала,
· уметь составлять электронные формулы атомов, схемы видов химической связи,
· решать творческие задания.
Оборудование:
· периодическая система химических элементов Д.И.Менделеева;
· портрет Д. И. Менделеева;
· карточки с заданиями, играми;
· опросный лист;
· табло с названиями конкурсов, игр.
| Кто хочет съесть ядро ореха, должен расколоть его скорлупу. |
| Плавт |
| Старайся дать уму как можно больше пищи. |
| А. Толстой |
Ход урока
Подготовка к уроку начинается за неделю до смотра. Учащиеся знакомятся с основной частью смотра, указывается, что необходимо повторить по учебнику и тетради.
Домашнее задание к этому уроку
1. Составить кроссворд и красиво его оформить.
2. Приготовить 1–2 сообщения из рубрики “В мире занимательной химии” и “Знаешь ли ты?”
УЧИТЕЛЬ. Добрый день, ребята! Сегодня на уроке мы повторим и закрепим знания по теме строение атома, химическая связь. На нашем уроке разделим класс на три группы (по рядам), они будут соревноваться в конкурсах. За каждое выполненное задание команда получает по одному баллу. Конкурсы оценивает жюри. Баллы заносят в опросный лист.
Конкурс “химические понятия”
Учащиеся пишут химический диктант – учитель читает определение понятий по теме, а ученики на листках записывают по порядку названия терминов. После окончания диктовки ассистенты собирают работы и сдают их на проверку членам жюри.
Задания.
1. Сложная элетронейтральная система, состоящая из протонов, нейтронов, электронов.
|
|
|
(Атом)
2. Разновидности одного и того же химического элемента, имеющие одинаковый заряд ядра, но разное число нейтронов.
(Изотоп)
3. Совокупность атомов с одинаковым зарядом ядра.
(Химический элемент)
4. Заряженные частицы, образующиеся при присоединении или отдачи электронов атомами.
(Ионы)
5. Способность атомов химического элемента притягивать к себе общие электронные пары, участвующих в образовании химической связи.
(Электроорицательность).
6. Химическая связь, образующаяся при взаимодействии атомов одного и того же элемента-неметалла.
(Ковалентная неполярная связь)
7. Знаменитый английский физик, разработавший планетарную модель атома.
Конкурс капитанов
К доске вызываются “сильные” ученики представители каждой из команд и выполняют задание по карточкам.
Задание № 1.
1. Напишите электронную формулу и постройте энергетическую диаграммы для следующих атомов: Li, N, Cl.
2. Укажите положение этих элементов в Периодической системе химических элементов Д. И Менделеева.
Задание № 2.
1. Определите тип химической связи и запишите схему ее образования для веществ формулы, которых N2, LiCl, Ca.
Задание № 3.
Укажите знаком “—> ” ослабление металлических свойств и усиление неметаллических в следующих пятерках элементов. Объясните, на каком основании расставлялись знаки.
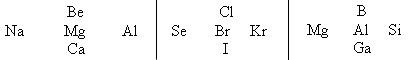
Конкурс «Аналитики»
УЧИТЕЛЬ. Для химика очень важно уметь логически мыслить. Вам предлагаются следующие задания.
Задание первой команде.
Пергамент Элюара.
Зная о высоких ценах на археологические находки, Жан Элюар, владелец антикварной лавки в Париже, решил разбогатеть. Он нанес на старинный пергамент фрагменты Периодической системы химических элементов, а затем состарил его. Затем инсценировал находку пергамента в песках у одной из египетских пирамид в присутствии толпы американских туристов. Однако эксперт, приглашенный оценить манускрипт, объявил его грубой фальшивкой.
|
|
|
Чем руководствовался эксперт, делая свое заключение? В чем была ошибка Жана Элюара?

Ответ. Впервые символы химических элементов ввел в употребление И. Я. Берцелиус в 1814 г. Цифры перед символами – порядковые номера были введены намного позже, неизвестно каким образом обозначали жрецы Древнего Египта известные им металлы и неметаллы.
Задание для второй команды.
На записи в тетради одного не очень аккуратного ученика, при проведении лабораторного опыта, попала кислота, и часть текста была испорчена. Восстановите пропавшие слова.

Ответ. Атом состоит из ядра и электронной оболочки. Число электронов в электронной оболочке равно числу протонов, а также равно номеру элемента. Число энергетических уровней определяется номером периода. Число внешних электронов определяется номером группы для элементов главных подгрупп.
|
|
|


