 |
Механические свойства тканей.
|
|
|
|
В биомеханике все ткани человека подразделяют по плотности и типу пространственной структуры на твердые (кость, эмаль и дентин зубов), мягкие (мышцы, эпителий, эндотелий, соединительная ткань, паренхима), жидкие (кровь, лимфа, ликвор, слюна, сперма).
Для многих живых тканей характерна нелинейная зависимость относительной деформации от приложенной поверхностной силы. Это означает, что их модуль Юнга не константа, а переменная величина, изменяющаяся в зависимости от σ и степени деформации. Модуль Юнга увеличивается по мере нарастания напряжения в силу разной природы упругих свойств биополимеров при малых и больших деформациях.
Молекулы, входящие в состав биополимеров, образуют многочисленные звенья, расположенные под углом друг к другу. Расположение звеньев определяется вторым началом термодинамики, соответствуя максимуму термодинамической вероятности. Под действием небольших усилий удлинение происходит за счет поворота звеньев, т. е. изменения ориентации и формы молекул. Если же напряжение превзойдет определенный предел, то звенья начинают не только поворачиваться, но и растягиваться за счет увеличения межатомных расстояний в молекулах. Чтобы растянуть звенья биополимеров, требуется гораздо большая сила, чем для их поворота. Проявлением перехода от первого ко второму типу процессов, обеспечивающих упругие свойства биополимера, служит резкое (скачком) возрастание модуля Юнга, начиная с определенного значения σ. В этом одна из причин нелинейной зависимости относительной деформации живых тканей от приложенного к ним напряжения.
Большая или меньшая выраженность нелинейности является наглядным критерием различий в механических свойствах разных тканей. Нелинейность ярко выражена в стенках артерий. Их деформация начинает развиваться уже при слабых усилиях (при повышении кровяного давления), но как только степень деформации достигнет физиологического предела прочности, потребуются гораздо большие усилия для дальнейшего растяжения сосудистой стенки. Тем самым предотвращается ее повреждение (разрыв). Подобным образом ведут себя все живые ткани, в которых зависимость 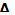 l от σ имеет нелинейный характер. Такая нелинейность присуща скелетным мышцам, особенно в состоянии сокращения. При малых деформациях модуль Юнга мышечной ткани сравнительно невелик (около 104 Па), а по мере увеличения деформации возрастает в десятки раз.
l от σ имеет нелинейный характер. Такая нелинейность присуща скелетным мышцам, особенно в состоянии сокращения. При малых деформациях модуль Юнга мышечной ткани сравнительно невелик (около 104 Па), а по мере увеличения деформации возрастает в десятки раз.
|
|
|
В живых тканях, как и в других композиционных средах, обладающих вязко-упругими и упруго-вязкими свойствами, процессы деформации развиваются вопределенной последовательности. Сразу после приложения нагрузки возникает мгновенная упругая деформация. С некоторым запаздыванием начинается медленная упругая деформация, которая на всем протяжении действия нагрузки постепенно нарастает с убывающей скоростью. На этот процесс накладывается вязкое течение компонентов живой ткани, возрастающее с постоянной скоростью пока на нее действует механическое усилие и сохраняющееся после снятия нагрузки.
Соотношение продолжительности этих процессов зависит от времени действия на ткань механического усилия: чем оно короче, тем в большей степени живая ткань напоминает упругое тело, и в ее реакции доминирует первый процесс, тогда как при длительном механическом воздействии живая ткань (даже такая, как кость) проявляет свойства вязкого тела, в частности пластичность (способность к остаточной деформации) и ползучесть (непрерывную пластическую деформацию под действием постоянной нагрузки).
Одним из важнейших механических свойств живых тканей является их прочность — способность противостоять разрушению, выдерживая заданную нагрузку. Она определяется как величина, прямо пропорциональная минимальной разрушающей поверхностной силе (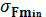 ). Наибольшей прочностью отличается костная ткань, которая начинает разрушаться при о порядка 108 Па. При внезапном ударе прочность живых тканей меньше, чем в условиях медленного развития деформации.
). Наибольшей прочностью отличается костная ткань, которая начинает разрушаться при о порядка 108 Па. При внезапном ударе прочность живых тканей меньше, чем в условиях медленного развития деформации.
|
|
|
Прочность мягких тканей определяется, прежде всего, присутствием в них соединительнотканных волокон, среди которых наиболее прочны коллагеновые. Их прочность на растяжение немного меньше, чем у костной ткани (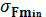 = 107—108 Па), но они составляют лишь небольшую часть органа, образованного мягкими тканями. Поэтому любой из органов обладает гораздо меньшей прочностью, чем кости, в прочность которых к тому же вносят вклад не только коллагеновые волокна, но и минеральные компоненты (главным образом, кристаллы гидроксиапатита). Стенки крупных артерий разрываются при
= 107—108 Па), но они составляют лишь небольшую часть органа, образованного мягкими тканями. Поэтому любой из органов обладает гораздо меньшей прочностью, чем кости, в прочность которых к тому же вносят вклад не только коллагеновые волокна, но и минеральные компоненты (главным образом, кристаллы гидроксиапатита). Стенки крупных артерий разрываются при  , а стенки вен — при
, а стенки вен — при 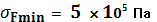 .
.
Стенки артерии и желудочков сердца в большей степени, чем другие ткани организма, подвержены продолжительной переменной нагрузке (механическим колебаниям). В таких условиях многие материалы разрушаются при нагрузках, меньших предела прочности. Это явление называется усталостью материала. Живые ткани обладают поразительно высокой способностью противостоять механической усталости. Она не накапливается в живых тканях благодаря их непрерывному обновлению, связанному с высоким уровнем метаболизма и продукции энтропии, эффективно компенсируемой потоком отрицательной энтропии. С возрастом интенсивность обмена веществ и энергии понижается, обновление тканей замедляется, в результате чего изменяется их прочность. Следовательно, механизмы развития, предупреждения и снятия усталости как механического свойства принципиально различны в живой и неживой природе. В большинстве органов и тканей прочность начинает уменьшаться в 20-летнем, а в коже и зубах — в 50-летнем возрасте.
Механические свойства тканей животных и человека обусловлены в значительной степени следующими биополимерами: коллагеном, эластином, гликозаминогликанами, гликопротеинами и растворимыми протеинами. Во внеклеточной среде коллаген и эластин образуют волокна, а остальные биополимеры — основное вещество соединительной ткани.
|
|
|
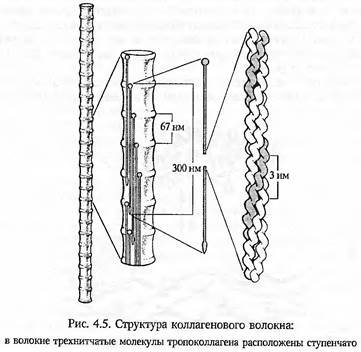 Коллаген синтезируется разными клетками соединительной ткани (фибробластами, хондробластами, остеобластами), эпителиоцитами и эндотелиоцитами, а потому представлен довольно большой (до 14 типов) группой очень стабильных трехспиральных белковых молекул. У высших позвоночных на его долю приходится около трети всех белков организма. У человека 50% всего коллагена содержится в костях, где он составляет 90% органического матрикса. Вторая половина сосредоточена в соединительной ткани, хряще, стенках сосудов, базальных мембранах многомембранных систем и т. д. Молекула коллагена состоит из трех полипептидных цепей, в каждой из которых примерно 1000 аминокислотных остатков, среди которых доминирует глицил — на его долю приходится примерно 33% всех аминокислотных остатков первичной структуры коллагена. Кроме глицила, в коллагене много аланила, пролила, оксипролила и оксилизила. Два последних специфичны для коллагена. Вторичная структура — β-спираль с левосторонним направлением вращения. Три таких β -спирали посредством поперечных связей свиваются в тройную спираль (спирализованную суперструктуру) — тропоколлаген диаметром 1,0—1,5 нм и длиной до 270 нм. Цепи коллагена I типа имеют несколько потенциальных мест для образования поперечных связей, а также по одному участку для присоединения N- и С- терминальных фрагментов.
Коллаген синтезируется разными клетками соединительной ткани (фибробластами, хондробластами, остеобластами), эпителиоцитами и эндотелиоцитами, а потому представлен довольно большой (до 14 типов) группой очень стабильных трехспиральных белковых молекул. У высших позвоночных на его долю приходится около трети всех белков организма. У человека 50% всего коллагена содержится в костях, где он составляет 90% органического матрикса. Вторая половина сосредоточена в соединительной ткани, хряще, стенках сосудов, базальных мембранах многомембранных систем и т. д. Молекула коллагена состоит из трех полипептидных цепей, в каждой из которых примерно 1000 аминокислотных остатков, среди которых доминирует глицил — на его долю приходится примерно 33% всех аминокислотных остатков первичной структуры коллагена. Кроме глицила, в коллагене много аланила, пролила, оксипролила и оксилизила. Два последних специфичны для коллагена. Вторичная структура — β-спираль с левосторонним направлением вращения. Три таких β -спирали посредством поперечных связей свиваются в тройную спираль (спирализованную суперструктуру) — тропоколлаген диаметром 1,0—1,5 нм и длиной до 270 нм. Цепи коллагена I типа имеют несколько потенциальных мест для образования поперечных связей, а также по одному участку для присоединения N- и С- терминальных фрагментов.
Тройные спирали тропоколлагена полимеризуются, объединяясь ковалентными связями также в спиралевидные фибриллы диаметром 1—12 мкм и длиной до 10 мкм, а те, в свою очередь, объединяются в коллагеновые волокна разной толщины (от 20 до 200 мкм). Четвертичные коллагеновые структуры тоже стабилизируются поперечными связями. Такое завершение строительства коллагеновых волокон осуществляется во внеклеточной среде (рис. 4.5). В костях они называются оссеиновыми, а в хрящах — хондриновыми волокнами. В кислой среде волокна разрушаются протеазами на молекулярные фрагменты. Такое разрушение оссеиновых волокон происходит, например, при резорбции кости остеокластами в процессе ее ремоделирования.
|
|
|
В сухожилиях, связках, стенках кровеносных сосудов коллагеновые волокна не переплетаются и в покое имеют гофрированные очертания, будучи уложены «со слабиной», а не «в натяг». При растягивании они вначале распрямляются, а затем могут удлиняться (без разрыва) не более чем на 10—20%. При таком удлинении предел прочности составляет, а модуль Юнга — 107—108 Па, тогда как при распрямлении он на 3—4 порядка меньше. В коже (дерме) коллагеновые волокна организованы в трехмерную сетку фибрилл, образующих волнистые ромбы.
Эластин — фибриллярный гликопротеин с молекулярной массой 70 кДа, обладающий упругостью. Она обусловлена обилием в первичной структуре (полипептидной цепи) аминокислотных остатков с неполярными группами. Среди них много пролила и глицила (как в коллагене), но очень мало гидроксипролила и отсутствует гидроксилизил. Молекулы эластина секретируются клетками во внеклеточное пространство. Там из них образуются волокна и слои, в которых отдельные молекулы связаны ковалентными сшивками в обширную сеть.
У эластина нет определенной третичной структуры — его полипептидная цепь может переходить от одной конформации к другой, от нее — к третьей и так далее. Под действием внешней силы каждая молекула способна растягиваться и сжиматься, вследствие чего вся эластиновая сеть может растягиваться и сжиматься наподобие резины (рис. 4.6). Полипептидные цепи, соединенные друг с другом в определенных местах жесткими связями, образуют парные, спирально скрученные нити. Они объединяются в волокна, в которых есть участки как с упорядоченным, так и с беспорядочным расположением молекул. Эластические волокна имеют модуль Юнга от 105 до 107 Па и способны растягиваться более чем в 2 раза, т. е. на 200%, а не на 10—20%, как коллагеновые. У человека много эластина содержится в восходящем отделе аорты. В шее копытных млекопитающих выйная связке образована главным образом эластином (он составляет почти 100% сухой массы). Благодаря этому животное может низко (до земли) опускать голову и довольно экономно расходовать мышечные усилия на поддержание головы в поднятом положении.
Основное вещество соединительной ткани образовано гликопротеинами и гликозаминогликанами (их раньше называли мукополисахаридами). Оно имеет очень невысокий модуль Юнга, относится к вязким средам и выполняет три биомеханические функции:
1) перераспределение нагрузки между волокнами;
|
|
|
2) эффективную изоляцию отдельных волокон, что предотвращает распространение разрывов при их локальном возникновении;
3) уменьшение трения при распрямлении коллагеновых волокон.
В разных тканях преобладают разные типы коллагена, а это, в свою очередь, определяется той ролью, которую коллаген играет в конкретном органе или ткани.
 Например, в пластинчатой костной ткани, из которой построено большинство плоских и трубчатых костей скелета, коллагеновые волокна имеют строго ориентированное направление: продольное — в центральной части пластинок, поперечное и под углом — в перифирической. Это способствует тому, что даже при расслоении пластинок фибриллы одной пластинки могут продолжаться в соседние, создавая таким образом единую волокнистую структуру кости.
Например, в пластинчатой костной ткани, из которой построено большинство плоских и трубчатых костей скелета, коллагеновые волокна имеют строго ориентированное направление: продольное — в центральной части пластинок, поперечное и под углом — в перифирической. Это способствует тому, что даже при расслоении пластинок фибриллы одной пластинки могут продолжаться в соседние, создавая таким образом единую волокнистую структуру кости.
Поперечно ориентированные коллагеновые волокна могут вплетаться в промежуточные слои между костными пластинками, благодаря чему достигается прочность костной ткани.
В сухожилиях коллаген образует плотные параллельные волокна, которые дают возможность этим структурам выдерживать большие механические нагрузки. В хрящевом матриксе коллаген образует фибриллярную сеть, которая придает хрящу прочность, а в роговице глаза коллаген участвует в образовании гексогональных решёток десцементовых мембран, что обеспечивает прозрачность роговицы, а также участие этих структур в преломлении световых лучей.
В дерме фибриллы коллагена ориентированы таким образом, что формируют сеть, особенно хорошо развитую в участках кожи, которые испытывают сильное давление (кожа подошв, локтей, ладоней), а в заживающей ране они агрегированы весьма хаотично.
Полиморфизм коллагена
Коллаген — ярко выраженный полиморфный белок. В настоящее время известно 19 типов коллагена, которые отличаются друг от друга по первичной структуре пептидных цепей, функциям и локализации в организме. Вариантов α-цепей, образующих тройную спираль, гораздо больше 19 (около 30). Для обозначения каждого вида коллагена пользуются определенной формулой, в которой тип коллагена записывается римской цифрой в скобках, а для обозначения α-цепей используют арабские цифры: например коллагены II и III типа образованы идентичными альфа-цепями, их формулы, соответственно [α1(II)]3 и [α1(IIШ)]3; коллагены I и IV типов являются гетеротримерами и образуются двумя различными типами α-цепей, их формулы, соответственно [α1(I)]2α2(I) и [α1(IV)]2α2(IV). Индекс за скобкой обозначает количество идентичных α-цепей.
Эластин — основной белок эластичных волокон, которые в больших количествах содержатся в межклеточном веществе таких тканей, как кожа, стенки кровеносных сосудов, связки, лёгкие. Эти ткани обладают очень важными свойствами: они могут растягиваться в несколько раз по сравнению с исходной длиной, сохраняя при этом высокую прочность на разрыв, и возвращаться в первичное состояние после снятия нагрузки. Резиноподобные свойства названных тканей обеспечиваются особенностями состава и строения эластина — гликопротеина.
 В межклеточном пространcтве молекулы эластина образуют волокна и слои, в которых отдельные пептидные цепи связаны множеством жестких поперечных сшивок в разветвленную сеть. Структуры, образующиеся при этом, называются десмозинами (десмозин или изодесмозин). Кроме десмозинов, в образовании поперечных сшивок может участвовать лизиннорлейцин.
В межклеточном пространcтве молекулы эластина образуют волокна и слои, в которых отдельные пептидные цепи связаны множеством жестких поперечных сшивок в разветвленную сеть. Структуры, образующиеся при этом, называются десмозинами (десмозин или изодесмозин). Кроме десмозинов, в образовании поперечных сшивок может участвовать лизиннорлейцин.
Наличие ковалентных сшивок между пептидными цепочками с неупорядоченной, случайной конформацией позволяет всей сети волокон эластина растягиваться и сжиматься в разных направлениях, придавая соответствующим тканям свойство эластичности.
Следует отметить, что эластин синтезируется как растворимый мономер, который называется «тропоэластин». После образования поперечных сшивок эластин приобретает свою конечную внеклеточную форму, которая характеризуется нерастворимостью, высокой стабильностью и очень низкой скоростью обмена.
|
|
|


