 |
Химические свойства аминокислот
|
|
|
|
Аминокислоты могут участвовать во многих реакциях с участием
a-амино, a-карбокси и различных функциональных R-групп. Эти реакции подробно рассмотрены в методическом указании «Химия и биохимия аминокислот и полипептидов». Отметим лишь некоторые реакции, имеющие особо важное значение.
Реакция с нингидрином (рН>5) лежит в основе обнаружения и количественного определения аминокислот и белков.
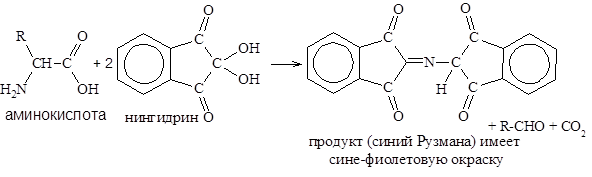
Интенсивность образующейся окраски, оценивают, измеряя поглощение света при длине волны 540 нм (для пролина – 440 нм).
Для идентификации аминокислот служит также получение: 1) фенилтиогитантионовых (ФТТ) производных аминокислот, поглощающих в УФ области; 2) дансильных флуоресцирующих производных (ДНФ) и т.д.
Реакция меланоидинообразования
Для пищевиков представляет интерес реакция аминокислот с соединениями, содержащими карбонильную группу  , с различными альдегидами и восстанавливающими сахарами (глюкозой, рибозой и отчасти фруктозой). В результате этой реакции происходит разложение как исходной аминокислоты, так и реагирующего с ней восстанавливающего сахара.
, с различными альдегидами и восстанавливающими сахарами (глюкозой, рибозой и отчасти фруктозой). В результате этой реакции происходит разложение как исходной аминокислоты, так и реагирующего с ней восстанавливающего сахара.

Альдегиды, образовавшиеся из аминокислот, обладают определенным запахом, от которого в значительной степени зависит аромат многих пищевых продуктов.
Лейцин дает запах ржаного хлеба, глицин – карамели, фурфурол – запах зеленого яблока, гидроксиметилфурфурол – запах меда.
Далее фурфурол и гидроксиметилфурфурол реагируют с новой молекулой аминокислоты в результате образуются темноокрашенные соединения – меланоидины. Образование их объясняет наблюдаемое потемнение многих пищевых продуктов во время их изготовления. Особенно интенсивно реакция между аминокислотами и восстанавливающими сахарами происходит при повышенной температуре, повышенной влажности имеющей место во время сушки пищевых продуктов, овощей, фруктов, молока, солода. Образование золотисто-коричневой корочки, специфического аромата и вкуса хлеба зависят в основном от меланоидиновых реакций, происходящих при выпечке. Реакция меланоидинообразования приводит к снижению пищевой ценности пищевых продуктов, так как разложению подвергаются незаменимые аминокислоты.
|
|
|
ПЕПТИДЫ
Аминокислоты соединяются друг с другом ковалентной пептидной связью. Образование ее происходит за счет a-аминогруппы (–NH2) одной аминокислоты и a-карбоксильной (–СООН) группы другой с выделением молекулы воды.
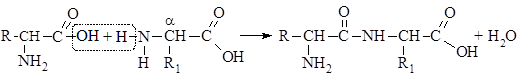
В результате реакции поликонденсации можно получить соединения, составленные из многих аминокислотных остатков – полипептиды. Название пептидов складывается из названия аминокислот, входящих в состав пептида. Если в образование пептидной связи  участвует карбоксильная группа аминокислот, суффикс «ин» удлиняется на «ил»; так, дипептид, состоящие из глицина и аланина, называется глиц ил –алан ин (сокращенно(Гли–Ала); трипептид, содержащий глицин, аланин, лизин, называетсчя глиц ил –алан ил –лиз ин. Концевая аминокислота, в которой карбоксильная группа остается незатронутой в пептидах, не меняет своего названия.
участвует карбоксильная группа аминокислот, суффикс «ин» удлиняется на «ил»; так, дипептид, состоящие из глицина и аланина, называется глиц ил –алан ин (сокращенно(Гли–Ала); трипептид, содержащий глицин, аланин, лизин, называетсчя глиц ил –алан ил –лиз ин. Концевая аминокислота, в которой карбоксильная группа остается незатронутой в пептидах, не меняет своего названия.
Каждый пептид содержит только одну свободную a-амино- и
a-карбоксильную группу, которые находятся на концевых остатках аминокислот. Эти группы и R-группы некоторых аминокислот могут быть ионизированы, поэтому пептиды могут нести заряды, и могут быть электронейтральными (т.е. иметь изоэлектрическую точку (ИЭТ). Это свойство пептидов используется для их разделения методами ионной хроматографии и электрофореза. Как и другие соединения, пептиды могут вступать в химические реакции, определяемые наличием у них групп -NH2, -COOH, и R групп-аминокислот. Одной из важных реакций для пептидов является реакция гидролиза. Реакция гидролиза всех пептидных связей путем кипячения растворов пептидов в присутствии сильной кислоты или щелочи используется при определении их аминокислотного состава и состава белков.
|
|
|
Гидролиз пептидных связей может быть осуществлен также действием некоторых ферментов, которые расщепляют пептидные связи избирательно, с образованием коротких пептидов. Например, трипсин гидролизует связи, образованные карбоксильными группами лизина, аргинина; химотрипсин-карбоксильными группами фенилаланина, тирозина, триптофана. Такой избирательный анализ оказывается очень полезным при установлении аминокислотной последовательности белков и пептидов.
Кроме пептидов, образующихся в результате частичного гидролиза молекул белка, существует много пептидов, встречающихся в живых организмах как свободные соединения.
Многие природные пептиды отличаются по своей структуре от белков; такие пептиды присутствуют во всех типах организмов. В структурном отношении пептиды небелковой природы весьма разнообразны: отличаются по размерам, наличию циклических структур, разветвленности, наличию D- и
L-аминокислот и, в некоторых отдельных случаях, по уникальному строению пептидной связи. К наиболее значимым пептидам можно отнести карнозин и ансерин, глутатион, аспартам.
Карнозин и Ансерин. Эти дипептиды найдены в мышечных тканях позвоночных, в том числе и в мышцах человека. Оба они содержат b-аланин – структурный изомер a-аланина.

Эти дипептиды служат для поддержания постоянного рН в клетках мышц, т.е действуют как буферы, также они участвуют в сокращении мышц, в процессах окислительного фосфорилирования т.е в образовании АТФ.
Глутатион (g-глутамилцистеинилглицин) – трипептид, присутствует во всех животных, растениях и микроорганизмах.

Отличительная структурная особенность глутатиона, состоит в том, что в образовании пептидной связи участвует g-карбоксильная группа глутаминовой кислоты, а не a-карбоксильную группа. Существуют две формы глутатиона: восстановленная (SH-глутатион) и окисленная (S-S-глутатион). Взаимопревращения одной формы в другую катализируется ферментом глутатионредуктазой.
|
|
|

В настоящее время известны лишь некоторые из физиологических функций глутатиона:
1) участие в транспорте аминокислот через клеточные мембраны;
2) поддержание восстановленного состояния железа (Fe+2) в гемоглобине;
3) входит в состав фермента глутатионпероксидазы, который защищает клетки от разрушающего действия Н2О2.
4) участвует в детоксикации ряда чужеродных для живой клетки соединений (галогенсодержащие алифатические или ароматические углеводороды). Переводит их в водорастворимые соединения, которые выводятся из организма почками.
5) восстановленный глутатион защищает SH-группы белка от окисления, сам при этом превращается в окисленный.
6) влияет на технологические свойства зерна и муки. Восстановленный глутатион вызывает восстановление и разрыв дисульфидных связей (S–S) в молекуле белков клейковины, т.е разрушает ее. Тесто из такой муки обладает плохими структурно-механическими свойствами оно ослабляется, расплывается из него нельзя получить хлеб нормального качества.) Много глутатиона в старых дрожжах и зерновых зародышах, что следует учитывать в хлебопечении. Восстановленный глутатион способен активировать протеиназы (ферменты ращепляющие белки) зерна и муки, при этом начинается усиленно протекать протеолиз белков клейковины и вызванное им разжижение теста. Глутатион способствует накоплению в пиве азотистых соединений сравнительно большой молекулярной массы, что вызывает образование мути в пиве и ухудшает его потребительские свойства.
БЕЛКИ
Функции белков
Полипептиды, содержащие больше 51 аминокислоты, относятся к белкам. Белки входят в состав всех клеток и тканей живых организмов. Около 50% сухого вещества клетки приходится на белки.
Белки характеризуются определенным элементарным составом. Химический анализ показал наличие во всех белках углерода (50-55%), кислорода (21-24%), азота (15-18%), водорода (6-7%), серы (0,3-2,5%). В составе отдельных белков обнаружены также фосфор, йод, железо, медь и некоторые другие макро- и микроэлементы, в различных, часто очень малых количествах.
|
|
|
Белками (протеинами, от греческого protas – первый, важнейший) называют высокомолекулярные азотсодержащие природные полимеры, молекулы которых построены из остатков аминокислот.
Аминокислоты – это алфавит белковой структуры; соединив их в различном порядке можно получить бесконечное число последовательностей, а, следовательно, и бесконечное количество разнообразных белков, выполняющих различные биологические функции:
1. Ферментативная (каталитическая). В биологических системах почти все реакции катализируются специфическими белками – ферментами. В настоящее время открыто около 300 различных ферментов, каждый из которых служит катализатором определенной биологической реакции. Синтез и распад веществ, их регуляция, перенос химических групп и электронов от одного вещества к другому осуществляется с помощью ферментов.
2. Строительная (структурная) функция. Белки образуют основу протоплазмы любой живой клетки, в комплексе с липидами они являются структурными компонентами клеточных мембран.
3. Двигательная функция. Любые формы движения в живой природе (работа мышц, движение ресничек и жгутиков у простейших, движение протоплазмы в клетке и т.д.) осуществляется белковыми структурами.
4. Транспортная функция. Перенос различных молекул, ионов осуществляется специфическими белками. Например, белок крови гемоглобин переносит кислород к тканям. Перенос жирных кислот по организму происходит с участием другого белка крови-альбумина.
5. Регуляторная функция. Регуляция углеводного, белкового, липидного обменов осуществляется с помощью гормонов, которые по своему строению относятся к белкам (инсулин) или пептидам (окситоцин, вазопрессин и др.).
6. Защитная – эту функцию выполняют иммуноглобулины (антитела). Они обладают способностью обезвреживать бактерии, вирусы, чужеродные белки, попавшие в организм извне. Процесс свертывания крови, защищающий организм от ее потери, основан на превращениях белка – фибриногена. Кератин – белок волосяного защитного покрова.
7. Фоторецепторные белки: например, родопсин, участвующий в зрительных процессах.
8. Резервные белки используются, как запасной материал для питания развивающегося зародыша и новорожденного организма – это белки семян зернобобовых культур, альбумин – яичный белок, казеин молока. Ферретин – белок животных тканей в котором запасено железо. Резервные белки являются важнейшими компонентами растительной и животной пищи.
9. Питательная функция.Суточная потребность человека в белках составляет 100-120 г при трате общего количества энергии 12 000 кДж, для людей физического труда – 130-150 г, а для детей раннего возраста – 55-72 г. Отсутствие или недостаток белков в пище сопровождается задержкой роста, падением веса тела и вызывает ряд общих патологических изменений в организме. Особенно чувствительны к белковому голоданию нервная и эндокринная система, и в первую очередь кора головного мозга.
|
|
|
Состояние белкового обмена в организме зависит не только от количества принимаемого с пищей белка, но и от его качественного состава, определяющего биологическую ценность пищевых белков.
Принимаемые с пищей белки значительно отличаются по своему аминокислотному составу и биологической ценности. Биологическая ценность белков определяется, главным образом, следующими факторами:
– Близостью аминокислотного состава пищевого белка к аминокислотному составу белков тела. Чем ближе аминокислотный состав принимаемого пищевого белка к аминокислотному составу белков организма, тем выше его биологическая ценность. Для человека, например, белки мяса, молока, яиц биологически более ценны, поскольку их аминокислотный состав ближе к аминокислотному составу органов и тканей человека. Однако это не исключает приема растительных белков, в которых содержится необходимый набор аминокислот, но в другом соотношении.
– Степенью усвоения пищевого белка. Степень усвоения любого пищевого продукта зависит также от эффективности его распада под влиянием ферментов желудочно-кишечного тракта. Ряд белковых веществ, например, фиброин шелка, кератин волос, рогов, копыт и др., несмотря на их близкий аминокислотный состав к белкам тела человека, почти не используются в качестве пищевого белка, поскольку они не гидролизуются протеиназами желудочно-кишечного тракта человека и большинства животных.
– Содержанием в белках незаменимых аминокислот. Известно, что из 20 аминокислот, входящих в состав белков, только 10 способны синтезироваться в организме человека и животных – это заменимые аминокислоты, остальные 10 аминокислот (валин, лейцин, изолейцин, треонин, метионин, триптофан, фенилаланин, лизин, гистидин, аргинин) не синтезируются в организме и являются незаменимыми. Такие аминокислоты, как гистидин и аргинин относятся к полузаменимым (частично незаменимым), т.е. они могут синтезироваться в организме, но в количестве, недостаточном для сохранения нормальной жизнедеятельности человека. Следовательно, незаменимые аминокислоты должны быть обязательно введены в организм человека или животного с пищей. Если их будет в пище недостаточно, то нормальное развитие и жизнедеятельность организма нарушаются.
Также следует отметить, что недостаток в пище одной незаменимой аминокислоты ведет к неполному усвоению других аминокислот.
Вместе с тем было доказано, что потребности отдельных незаменимых аминокислот могут быть частично компенсированы заменимыми аминокислотами. Например, тирозин снижает потребность в фенилаланине, цистеин снижает потребность в метионине, а глутаминовая кислота в аргинине.
Для оценки биологической ценности пищевого белка важное значение имеет знание его аминокислотного состава. Отдельные белки могут быть биологически неполноценны по своему аминокислотному составу. Однако необходимо исследовать аминокислотный состав не отдельных белков, а всего их комплекса, содержащегося в пищевом продукте. Только при таком подходе могут быть получены правильные данные об аминокислотном составе, а, следовательно, и о пищевой ценности продукта. Так, например, цельное кукурузное зерно содержит 2,5% лизина, 0,7% триптофана, в то время как выделенный из кукурузы белок зеин не содержит лизина вообще, а триптофана в нем всего 0,1%. Поэтому, для питания большое значение имеет сбалансированность аминокислотного состава белков.
По содержанию в белке незаменимых аминокислот, определяемых химическими методами, вычисляют аминокислотный скор, которым характеризуют биологическую ценность белка. В продукте определяют содержание каждой незаменимой аминокислоты. Найденное количество вычисляют в процентах к содержанию той же аминокислоты в идеальном белке (куриного яйца, молока). Чаще всего в качестве идеального белка принимают аминокислотную шкалу комитета ФАО/ВОЗ. Аминокислотный скор каждой незаменимой аминокислоты в идеальном белке (шкале ФАО/ВОЗ) принимают за 100 %. Расчет скора ведут по формуле:
 , ,
| (1) |
где А – количество, незаменимой аминокислоты в 1 г исследуемого белка, мг;
В – количество этой же незаменимой аминокислоты в 1 г идеального белка (данные аминокислотной шкалы ФАО/ВОЗ), мг.
По вычисленному скору определяют лимитирующую биологическую ценность изучаемого белка – аминокислоту с наименьшим скором.
Таким образом, для нормального роста и гармоничного развития организма человека большое значение имеют составление и подбор пищевых продуктов, содержащих оптимальный аминокислотный состав и обеспечивающих физиологически полноценное питание для различных групп населения.
Имеется много других белков, функции которых довольно необычны. Например, монеллин – белок, выделенный из африканского растения, имеет очень сладкий вкус. Его изучают как вещество нетоксичное и не способствующее ожирению, с целью использования в пищу вместо сахара. Плазма крови некоторых антарктических рыб содержи белок, обладающий свойствами антифриза.
Технология многих производств основана на переработке белков, изменении их свойств; в кожевенной промышленности, при выделке мехов, натурального шелка, выработке сыров, хлеба и т.д.
********* ДУДИНСКАЯ
|
|
|


