 |
Эквивалент. Молярная масса эквивалента
|
|
|
|
Институт металлургии и химии

Кафедра химии
Практические занятия по теме
«Основные законы химии»
По дисциплине «Химия»
Учебно-методическое пособие
ЧЕРЕПОВЕЦ
Практические занятия по теме «Основные законы химии» по дисциплине «Химия». Учебно-методическое пособие к практическим занятиям по дисциплине «Химия». Череповец: ЧГУ, 2003. с. 32.
Пособие включает в себя краткие теоретические сведения, примеры решения задач и варианты контрольных заданий по теме «Основные законы химии» курса общей химии. Содержание учебно-методического пособия соответствует государственному стандарту дисциплины «Химия» для химических и инженерно-технических специальностей.
Рассмотрено на заседании кафедры химии, протокол № 7 от 21.03.2003 г.
Одобрено редакционно-издательской комиссией Института металлургии и химии ЧГУ, протокол № 2 от 31.03.2003 г.
Составители: О.А. Калько – канд. техн. наук, доцент
Н.В. Кунина – ст.преподаватель
Рецензенты: В.А. Котенко, канд. техн. наук, доцент (ЧГУ);
Г.В. Козлова, канд. хим. наук, доцент (ЧГУ)
Научный редактор: О.А. Калько – канд. техн. наук, доцент
© Череповецкий государственный
университет, 2003
МОЛЬ. МОЛЯРНАЯ МАССА
Истинные массы атомов и молекул очень малы, порядка 10-24¸10-20 г. Пользоваться столь малыми величинами неудобно. Поэтому в химии имеют дело не с абсолютными значениями масс, а с относительными атомными и молекулярными массами.
Относительной атомной массой химического элемента Аr называется величина, равная отношению средней массы атомов данного элемента (с учетом процентного содержания его изотопов в природе) к  массы изотопа углерода 12 (12С). Значения атомных масс всех химических элементов содержатся в Периодической системе Д.И. Менделеева.
массы изотопа углерода 12 (12С). Значения атомных масс всех химических элементов содержатся в Периодической системе Д.И. Менделеева.
|
|
|
 массы изотопа углерода
массы изотопа углерода  С принята за атомную единицу массы (а.е.м.).
С принята за атомную единицу массы (а.е.м.).

 .
.
Относительной молекулярной массой вещества Mr называется отношение массы его молекулы к  массы изотопа углерода 12.
массы изотопа углерода 12.
Связь между Mr и истинной массой вещества m в кг выражается формулами

 .
.
В 1971 году в Международную систему единиц измерения (СИ) была введена единица количества вещества – моль. Моль – количество вещества, содержащее столько структурных элементарных частиц (атомов, молекул, ионов, электронов, эквивалентов и т.д.), сколько содержится атомов в 0,012 кг изотопа углерода 12. Число атомов в 0,012 кг углерода равно 6,02×1023 атомов. Эта величина называется постоянной Авогадро N А и является одной из важнейших универсальных постоянных
N А = (6,022045±0,000031)×1023 моль-1.
Масса 1 моль вещества называется молярной массой M и представляет собой отношение массы вещества m к его количеству n, кг/моль (или г/моль):
 .
.
Численное значение молярной массы в г/моль совпадает с относительной молекулярной или атомной массой данного вещества.
Пример 1. Сколько молекул СО получится при сгорании 4 мг углерода?
Р е ш е н и е
1. Составим уравнение реакции горения углерода с образованием СО
2С + О2 = 2СО,
из которого следует, что при сгорании 1 моль углерода образуется 1 моль газа СО.
2. Найдем количество моль углерода, которое будет равно числу моль СО


3. Тогда число молекул оксида углерода (II) найдем по формуле
 N СО = n CO× NA = 3,33×10-4×6,02×1023 = 2,00×1020.
N СО = n CO× NA = 3,33×10-4×6,02×1023 = 2,00×1020.
Пример 2. Определите абсолютную массу молекулы серной кислоты в граммах.
Р е ш е н и е
1. Найдем относительную молекулярную массу молекулы H2SO4
Mr = 2× Ar (H) + Ar (S) + 4× Ar (O) = 2×1 + 32 + 4×16 = 98 а.е.м.
2. Так как Mr и масса 1 моль вещества численно равны друг другу, то
|
|
|
 .
. 
Пример 3. Сколько моль атомов азота содержится в 1 кг нитрата аммония?
Р е ш е н и е
1. Масса 1 моль нитрата аммония NH4NO3 равна
М = 2× Ar (N) + 4× Ar (H) + 3× Ar (O) = 2×14 + 4×1 + 3×16 = 80 г/моль.
2. Из формулы вещества следует, что 1 моль нитрата аммония содержит 2 моль атомов азота, тогда
n N = 2 n нитрата =  .
.
Пример 4. Массовая доля фосфора в его оксиде равна 43,7 % мас. Определите простейшую формулу оксида.
Р е ш е н и е
Обозначим числа атомов фосфора и кислорода в простейшей формуле оксида через х и у. Атомные массы данных элементов равны 31 и 16. Значит, массы фосфора и кислорода в составе оксида относятся друг к другу как 31 х:16 у. По условию задачи в 100 г оксида содержится 43,7 г фосфора и 56,3 г кислорода. Следовательно
31 х:16 у = 43,7: 56,3 или х: у = 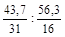 = 1,41: 3,52.
= 1,41: 3,52.
Чтобы выразить полученное соотношение целыми числами, необходимо оба значения поделить на наименьшее из них
х: у =  = 1: 2,5.
= 1: 2,5.
Поскольку дробные коэффициенты в химических формулах не употребляются, то оба члена последнего соотношения умножим на два
х: у = 2: 5.
Таким образом, простейшая формула оксида фосфора Р2О5.
З А Д А Ч И
1. Молекула некоторого вещества имеет массу, равную 1,2×10-25 кг. Определите молекулярную массу вещества.
2. Сколько молекул СО2 получится при сгорании 2 г углерода?
3. Если отсчитывать по 60 молекул в 1 минуту, то сколько лет потребуется для того, чтобы пересчитать то количество молекул, которое содержит 1 кг йода (год считать равным 365 дням)?
4. Сравните число молекул, содержащееся в 4 кг соляной кислоты, с числом молекул, содержащимся в 4 кг азотной кислоты. В каком случае и во сколько раз число молекул больше?
5. Выразите в молях 6,02×1022 молекул ацетилена. Какова молярная масса этого соединения?
6. В какой массе аммиака содержится столько же молекул, сколько содержится молекул в 1 кг хлора?
7. Сколько грамм СО необходимо сжечь, чтобы получить столько же молекул СО2, сколько их содержит 10 г водорода?
8. Сколько моль кислорода образуется при разложении 490 г KСlO3?
9. Сколько грамм цинка и серной кислоты необходимо взять, чтобы получить 4 моль водорода?
10. В каком количестве хлорида натрия содержится столько же натрия, сколько его находится в 5 моль сульфата натрия?
|
|
|
11. В какой массе хлорида натрия содержится столько же натрия, сколько его находится в 2 моль нитрита натрия?
12. Сколько грамм серы содержится в 0,5 моль сульфата железа (II)?
13. Сколько грамм кислорода потребуется для окисления 0,25 моль алюминия?
14. Сколько грамм СО потребуется для полного восстановления 3,42×1026 молекул оксида железа (III)?
15. Сколько молекул сульфида цинка может образоваться из смеси, в состав которой входят 130 г цинка и 48 г серы?
16. Исходя из молярной массы углерода, определите абсолютную массу атома углерода в граммах.
17. Вычислите, сколько азота в граммах содержится в 1 кг нитрата калия.
18. Исходя из молярной массы воды, определите абсолютную массу молекулы воды в граммах. Сколько молекул воды может образоваться при разложении 1 г пероксида водорода?
19. Вычислите, сколько азота содержится в 1 кг дигидрофосфата аммония. Определите весовое соотношение между водородом и азотом.
20. Вычислите, сколько моль азотной кислоты потребуется для получения 1 кг нитрата кальция.
21. Напишите уравнение реакции гидроксида железа (III) с соляной кислотой, при которой образуется хлорид дигидроксожелеза. Сколько грамм гидроксида и кислоты необходимо для получения 0,1 моль данной соли?
22. Сравните число молекул, содержащееся в 1 кг перманганата калия, с числом атомов кислорода, содержащимся в 100 г азотной кислоты. В каком случае и во сколько раз число частиц больше?
23. Сколько атомов кислорода расходуется при сжигании 2 моль магния?
24. Сколько грамм оксида ртути (II) потребуется для получения такого количества кислорода, которое понадобится для окисления 7 г хлора с образованием его высшего оксида?
25. Определите весовое соотношение (в % мас.) между азотом и кислородом в гидросульфите аммония.
26. Кристаллогидрат содержит 18,6 % мас. натрия, 25,8 % мас. серы, 19,4 % мас. кислорода и 36,2 % мас. воды. Выведите формулу кристаллогидрата, зная, что его молекулярная масса равна 248 г/моль.
27. Определите простейшую формулу щавелевой кислоты, если известно, что в 20 г этой кислоты содержится 0,444 г водорода, 5,33 г углерода, остальное – кислород.
|
|
|
28. Установите формулу кристаллогидрата сульфата железа (II), если известно, что эта соль содержит 45,32 % воды по массе.
29. Сколько моль сульфида железа (II) получится при нагревании 7 г железа с 7 г серы? Какое вещество израсходуется полностью?
30. Сколько грамм кислорода требуется для окисления:
а) 1 моль алюминия; б) 35 г цинка; в) 3,01×1023 атомов магния?
ЗАКОНЫ ГАЗОВОГО СОСТОЯНИЯ
Закон Авогадро: в равных объемах любых газов, взятых при одной и той же температуре и одинаковом давлении, содержится одинаковое число молекул.
Это означает, что одно и то же число молекул любого газа занимает при одинаковых физических условиях один и тот же объем. Из закона Авогадро следует, что:
1. При условии Р,Т = const 1 моль любого газа занимает один и тот же объем VM, который называют молярным объемом. При нормальных условиях (н.у.) – давление 101,325 кПа (1 атм. или 760 мм рт. ст.), температура 273 К (0 °С) – этот объем V  = 22,4 дм3/моль;
= 22,4 дм3/моль;
2. Отношение масс равных объемов различных газов равно отношению их молярных масс
 ,
,
где m1, m2 – массы газов, г; M1, M2 – молярные массы газов, г/моль. Отношение  получило название относительной плотности первого газа по второму D
получило название относительной плотности первого газа по второму D  . Тогда
. Тогда
M1 = M2 × D  .
.
Зависимость между количеством идеального газа, его объемом, давлением и температурой можно выразить равенством, которое носит название уравнение Менделеева-Клапейрона
 ,
,
где  = n, моль; P – давление, Па; V – объем газа, м3; R = 8,314
= n, моль; P – давление, Па; V – объем газа, м3; R = 8,314  - универсальная газовая постоянная; T – температура, К.
- универсальная газовая постоянная; T – температура, К.
Если газообразная фаза представляет собой смесь нескольких газов, то по закону парциальных давлений, общее давление смеси газов, химически не взаимодействующих друг с другом, равно сумме парциальных давлений газов, составляющих смесь:
Р = Р1 + Р2 + Р3 + …,
где Р – общее давление; Р1, Р2, Р3 … - парциальные давления газов 1, 2, 3 ….
Парциальным давлением газа в смеси называется давление, которое производил бы этот газ, занимая при тех же физических условиях объем всей газовой смеси. То есть, парциальное давление i –того газа в смеси Рi можно вычислить по уравнению
Рi =  ,
,
где ni – число моль i –того газа в смеси.
Парциальное давление газа в смеси можно вычислить через общее давление смеси, используя мольную долю, по формуле
Pi = xi × P,
где xi  - мольная доля i –того газа в смеси.
- мольная доля i –того газа в смеси.
Пример 1. Вычислите плотность этана по водороду и воздуху.
Р е ш е н и е
Из закона Авогадро вытекает, что относительная плотность одного газа по другому равна отношению молекулярных масс этих газов, то есть:
1. Плотность этана С2Н6 по водороду Н2 равна
 .
.
2. Плотность этана С2Н6 по воздуху равна
|
|
|
 .
.
Пример 2. При 273 К в сосуде объемом 14 дм3 содержится 8 г водорода и 6,3×10-3 кг азота. Определите парциальное давление каждого газа и общее давление смеси.
Р е ш е н и е
1. Найдем количество вещества для каждого газа как отношение массы газа к его молярной массе
 ;
;  .
.
2. Вычисляем парциальное давление каждого газа
Р Н2 =  ,
,
Р N2 =  .
.
3. Тогда общее давление смеси газов найдем как сумму парциальных давлений газов, составляющих смесь
Р = Р Н2 + Р N2 = 6,48×105 + 3,65×104 = 6,845×105 Па.
Пример 3. Какой объем займет смесь газов, содержащая 14 г азота, 32 г кислорода и 35,5 г хлора, при нормальных условиях и в условиях, когда температуру повысят на 20 К, а давление увеличат на 0,5 атм.?
Р е ш е н и е
1. Определим общее число моль газов в смеси
n = n (N2) + n (O2) + n (Cl2) =
=  .
.
2. Найдем объем смеси газов при н.у., используя понятие V  = 22,4 дм3/моль
= 22,4 дм3/моль
V ° = n× V  = 2 × 22,4 = 44,8 дм3.
= 2 × 22,4 = 44,8 дм3.
3. Найдем объем смеси газов в условиях
Т = 273 + 20 = 293 К; Р = 1 + 0,5 = 1,5 атм. = 1,5× 101325 = 151987,5 Па,
используя уравнение Менделеева-Клапейрона
V =  .
.
З А Д А Ч И
1. Относительная плотность паров брома по воздуху равна 5,5. Определите молярную массу паров брома и запишите химическую формулу.
2. Шар объемом 5 дм3 при давлении 105 Па и температуре 27 °С поднят в верхние слои атмосферы, где давление составляет 103 Па, а температура ниже на 50°. Вычислите объем шара в новых условиях, если шар имеет легко растяжимую оболочку.
3. При 27 °С и 1 атм. масса газообразного вещества объемом 1,5 дм3 составляет 4,755 г. Определите молярную массу вещества и его количество в моль.
4. В автомобильной шине объемом 0,5 м3 воздух находится под давлением 1,8×105 Па. Сколько воздуха (в кг) находится в шине при температуре 10 °С?
5. Определите давление в сосуде объемом 5,6 дм3 при 298 К, содержащем 0,5 г водорода, 18,25 г хлороводорода и 35,5 г хлора.
6. Какова молярная масса газа, если 9,6 г данного газа занимает объем 2,52 дм3 при 300 К и давлении 121,59 кПа.
7. Определите давление оксида серы (IV) массой 16 г в сосуде вместимостью 24,5 дм3 при 298 К.
8. Сколько молекул содержится в смеси, содержащей хлор объемом 11,2 дм3 и водород объемом 22,4 дм3 при нормальных условиях?
9. Вычислите давление, при котором 2 г кислорода при температуре 0°С займет объем 1 дм3.
10. До какой температуры должен быть нагрет 1 г азота, чтобы при давлении 1,5 атм. он занимал объем 5 дм3?
11. Какой объем при нормальных условиях займет смесь газов, состоящая из 3,5 г азота, 640 г кислорода и 70 г оксида углерода (II)?
12. В одном из баллонов находится азот, а в другом кислород. Массы обоих газов одинаковы. В каком баллоне и во сколько раз больше давление при 27 °С?
13. Определите давление кислорода, если 0,1 кг этого газа находится в сосуде объемом 0,02 м3 при 20 0С.
14. 0,2.10-3 м3 водорода собраны над водой при 33 0С и давлении 96000 Па. Определите объем сухого водорода (н.у.). Упругость насыщенного водяного пара при 33 0С равна 5212 Па.
15. В закрытом сосуде объемом 6.10-3 м3 при 10 0С находится смесь, состоящая из 8,8.10-3 кг диоксида углерода; 3,2.10-3 кг кислорода и 1,2.10-3 кг метана. Вычислите общее давление газовой смеси и парциальное давление газов.
16. При н.у. масса 0,5.10-3 м3 газа равна 1,806.10-3 кг. Определите плотность газа по диоксиду углерода СО2 и метану CH4, а так же молекулярную массу газа.
17. Каково давление в сосуде ёмкостью 11,2 дм3 содержащем 42 г N2 и 8 г CH4.
18. Определите массу паров толуола С7Н8 в помещении объёмом 30 м3 при 25 0С. Давление паров толуола при этой температуре равно 2972 Па.
19. Объем резиновой камеры автомобильной шины равен 0,025 м3, давление в ней 5,0665.105 Па. Определите массу воздуха, находящегося в камере, при 20 0С.
20. При 17 0С и давлении 1,040.105 Па масса 0,624.10-3 м3 газа равна 1,56.10-1 кг. Определите молекулярную массу газа.
21. В газонаполненных лампах содержится смесь газов, имеющая объемный состав: 86 % мас. Ar и 14 % мас. N2. Рассчитайте парциальное давление каждого из газов, если общее давление равно 39990 Па.
22. Определите массу 10-3 м3 газовой смеси, содержащей (по объему) 50% водорода и 50% диоксида углерода (н.у.).
23. При нормальных условиях 1 г воздуха занимает объем 773 см3. Какой объем займет та же масса воздуха при 0 0С и давлении, равном 93,3 кПа?
24. Масса колбы вместимостью 750 см3, наполненной при 27 0С кислородом равна 83,3 г. Масса пустой колбы составляет 82,1 г. Определите давление кислорода.
25. 250 см3 водорода собрали над водой при 26 0С и давлении 98,7 кПа. Давление насыщенного пара воды при 26 0С составляет 3,4 кПа. Вычислите массу водорода и его объем при н.у.
26. Смешали 0,04 м3 азота, находящегося под давлением 96 кПа, с 0,02 м3 кислорода. Общий объем смеси 0,06 м3, а общее давление 97,6 кПа. Каким было давление взятого кислорода?
27. В 0,1 м3 воздуха содержится 6.10-3 м3 ксенона. В каком объеме воздуха (н.у.) содержится 1025 молекул ксенона?
28. Масса 87.10-6 м3 пара при 62 0С и давлении 1,01.105 Па равна 0,24.10‑3 кг. Вычислите массу вещества и массу одной молекулы вещества.
29. Массовая доля фосфора в одном из его оксидов равна 56,4 %. Плотность паров этого вещества по воздуху равна 7,6. Установите молекулярную формулу оксида.
30. Относительная плотность газа по воздуху равна 1,517. Рассчитайте количество вещества этого газа, которое заключается в его образце массой 11 г.
ЭКВИВАЛЕНТ. МОЛЯРНАЯ МАССА ЭКВИВАЛЕНТА
Эквивалентом Э(Х) называется некая реальная или условная частица (атом, молекула, ион, радикал и т.п.), которая может присоединять, замещать или быть каким-либо другим образом эквивалентна одному моль атомов или ионов водорода в химических реакциях. В общем случае эквивалент элемента или вещества Х можно найти по формуле
Э(Х) =  ,
,
где z* - число эквивалентности, равное тому количеству атомов или ионов водорода, которое эквивалентно (равноценно) частице Х.
Масса 1 моль эквивалента вещества или элемента Х называется молярной массой эквивалента М Э(Х) (г/моль). Она связана с молярной массой частицы Х соотношением
М Э(Х) = М (Х)× Э(Х) =  .
.
Значение числа эквивалентности z* элемента в каком-либо веществе равно модулю степени окисления (С.О.), проявляемой данным элементом в химическом соединении. Таким образом, расчет молярной массы эквивалента элемента следует вести по формуле
М Э(Х) =  .
.
Для веществ, не участвующих в данный момент в какой-либо химической реакции, число эквивалентности равно:
1) для оксидов – произведению числа атомов элемента N на его валентность В, проявляемую в данном оксиде;
2) для кислот – ее основности, то есть числу атомов водорода, способных замещаться на катионы металлов;
3) для оснований – его кислотности, то есть количеству ионов ОН-, замещаемых на кислотные остатки при реакциях с кислотами;
4) для солей (средних) – произведению числа катионов N Kt на элементарный заряд катиона Z Kt.
Таким образом, расчет молярной массы эквивалента вещества не участвующего в химической реакции следует вести по одной из формул:
М Э(оксида) =  , М Э(соли) =
, М Э(соли) =  ,
,
М Э(кислоты) =  , М Э(основания) =
, М Э(основания) =  .
.
Если вещество участвует в реакции ионного обмена, то z* принимают равным числу ионов Н+ или числу ионов ОН-, перешедших от одного вещества к другому, а молярная масса эквивалента рассчитывается по уравнению:
М Э =  =
=  .
.
При расчете молярной массы эквивалента вещества, выполняющего роль окислителя (восстановителя) в окислительно-восстановительной реакции, число эквивалентности принимают равным количеству принятых (отданных) электронов Ne:
М Э =  .
.
При решении некоторых задач, содержащих сведения об объемах газообразных участников реакции, целесообразно пользоваться не молярной эквивалентной массой, а молярным эквивалентным объемом вещества V Э, то есть объемом, который при данных физических условиях занимает 1 моль эквивалентов газа. Расчет V Э газа при нормальных условиях следует вести по формуле
 , дм3/моль,
, дм3/моль,
где Э – эквивалент элемента, составляющего газ; N – число атомов элемента в молекуле газа; 22,4 – молярный объем при н.у.
Достаточно часто уравнения химических реакций записывают в сокращенно-ионной форме, поэтому может возникнуть потребность в расчете молярной эквивалентной массы не молекулы, а иона. Для ионов М Э вычисляют по формуле
М Э(иона) =  .
.
Пример 1. Вычислите молярную эквивалентную массу углерода в соединении CS2.
Р е ш е н и е
Определяем степени окисления элементов в сероуглероде  2. Тогда
2. Тогда
М Э(С) =  .
.
Пример 2. Определите молярные эквивалентные массы следующих соединений: Н3РО3, Са(ОН)2, Na2CO3.
Р е ш е н и е
1. Основность фосфористой кислоты равна двум, тогда
М Э(Н3РО3) =  .
.
2. Кислотность гидроксида калия равна двум, следовательно
М Э(Са(ОН)2) =  .
.
3. Число катионов в карбонате натрия равно двум, а заряд катиона равен +1, значит
М Э(Na2CO3) =  .
.
Пример 3. Вычислите молярные эквивалентные массы гидроксидов висмута и марганца, участвующих в реакциях
1) Bi(OH)3 + 2HNO3 = Bi(OH)(NO3)2 + 2H2O;
2) Mn(OH)2 + Cl2 + KOH ® MnO2 + KCl + H2O.
Р е ш е н и е
1. Реакция Bi(OH)3 + 2HNO3 = Bi(OH)(NO3)2 + 2H2O является ионно-обменным процессом, так как протекает без изменения степеней окисления элементов. В данном случае 1 моль гидроксида висмута обменивается с молекулами азотной кислоты двумя ионами ОН-, поэтому
М Э(Bi(OH)3) =  = 130 г/моль.
= 130 г/моль.
2. Реакция Mn(OH)2 + Cl2 + KOH ® MnO2 + KCl + H2O является окислительно-восстановительным процессом. С.О. атома марганца в гидроксиде равна +2, а в продукте реакции она составляет +4. Таким образом, атом марганца теряет два электрона в процессе окисления, тогда
М Э(Mn(OH)2) =  = 44,5 г/моль.
= 44,5 г/моль.
Пример 4. Вычислите молярный эквивалентный объем кислорода и водорода при н.у.
Р е ш е н и е
1. Газ Н2 состоит из двух атомов водорода. Эквивалент каждого атома Н равен 1, тогда
 ;
;
2. Газ О2 содержит 2 атома кислорода. Чаще всего С.О. кислорода в сложном веществе равна –2, следовательно, эквивалент О равен 0,5. Тогда
 .
.
З А Д А Ч И
1. В какой массе гидроксида натрия содержится столько же эквивалентов, сколько в 140 г гидроксида калия?
2. Выразите в молях 3,01×1023 молекул аммиака. Определите молярную эквивалентную массу данного соединения.
3. Определите эквивалент и молярную массу эквивалента фосфора, кислорода и брома в соединениях фосфид водорода, вода, бромоводород.
4. Запишите реакцию образования гидрофосфата калия при взаимодействии ортофосфорной кислоты с гидроксидом калия. Вычислите молярную массу эквивалента кислоты в данной реакции.
5. Напишите уравнение реакции гидроксида железа (III) с соляной кислотой, при которой образуется хлорид дигидроксожелеза. Вычислите молярную массу эквивалента гидроксида в данной реакции.
6. Определите молярную эквивалентную массу серной кислоты и гидроксида меди (II) в реакциях:
А) H2SO4 + NaOH = NaHSO4 + H2O;
Б) Cu(OH)2 + 2HCl = CuCl2 + 2H2O.
7. Избытком КОН подействовали на раствор дигидрофосфата калия. Запишите уравнение реакции и определите молярную массу эквивалента исходной соли.
8. Вычислите молярные массы эквивалентов окислителя и восстановителя в окислительно-восстановительной реакции:
SO2 + Cl2 + 2H2O = H2SO4 + 2HCl.
9. Вычислите молярную эквивалентную массу гидроксохлорида кадмия в реакции с хлороводородом.
10. Вычислите эквивалент и эквивалентную массу H3PO4 при взаимодействии с гидроксидом калия с образованием: а) гидрофосфата; б) дигидрофосфата.
11. Напишите уравнение реакций Ni(OH)3 с хлороводородной кислотой, при которых образуются следующие соединения никеля: а) дигидроксохлорид; б) гидроксохлорид; в) трихлорид. Вычислите эквивалент и эквивалентную массу Ni(OH)3 в каждой из этих реакций.
12. Определите эквивалент и эквивалентную массу металла в следующих соединениях: Mn2O7, Mg2P2O7, Ca3(PO4)2, Ba(OH)2. Вычислите молярные эквивалентные массы каждого вещества.
13. Вычислите эквивалентную массу следующих соединений: Al2(SO4)3, H2S, Na2S2O3, P2O5.
14. Вычислите эквивалент и эквивалентную массу серной кислоты при взаимодействии с гидроксидом калия с образованием а) гидросульфата калия; б) сульфата калия.
15. Вычислите эквивалент и эквивалентную массу гидроксида кальция при взаимодействии с хлороводородной кислотой с образованием а) гидроксохлорида кальция; б) хлорида кальция.
16. Вычислите эквивалент и эквивалентную массу оксида магния и алюминия в следующих реакциях:
а) 2 НСl + MgO = MgCl2 + H2O;
б) 6 HNO3 + Al2O3 = 2 Al(NO3)3 + 3 H2O.
17. Вычислите эквивалентную массу следующих соединений: Mn2O7, Na2S2O8, (CuOH)2CO3, (NH4)2Fe(SO4)2.
18. Вычислите эквивалентную массу следующих соединений: CuO, (NH4)2S, Ca(HCO3)2, AI(OH)2Cl.
19. Вычислите эквивалентную массу следующих соединений: SnO2, Al2S3, SiH4, Fe(SCN)3, Cr2(HPO4)3.
20. Определите эквивалент и эквивалентную массу фосфора в следующих соединениях: РН3, Р2О5, Р2S3, КН2РО2.
21. Определите эквивалент и эквивалентную массу азота в следующих соединениях: а) аммиак; б) нитрат калия; в) нитрит калия; г) нитрид калия.
22. Определите эквивалент хлора и кислорода в следующих оксидах: Cl2О, Cl2О3, Cl2О5, Cl2О7. Эквивалент какого элемента остается постоянным и почему?
23. Сера образует три оксида, определите эквивалент серы и кислорода в этих оксидах. Эквивалент, какого элемента остается постоянным и почему?
24. Хром образует три оксида, определите эквивалент хрома и кислорода в этих оксидах. Эквивалент, какого элемента остается постоянным и почему?
25. Определите эквивалент и эквивалентную массу следующих кислот:
а) ортофосфорная; б) фосфорноватая.
26. Определите эквивалент и эквивалентную массу следующих кислот:
а) метафосфорная; б) фосфорноватистая.
27. Определите эквивалент и эквивалентную массу азота и серы в полуреакциях:
а) NO3 - ® NO2; б) S2O8 2- ® 2 SO42-.
28. Определите эквивалент и эквивалентную массу азота и серы в полуреакциях:
а) NO3- ® NH4+; б) SO32- ® SO42-.
29. Определите эквивалент и эквивалентную массу марганца в полуреакциях:
а) MnO4- ® MnO2; б) MnO42- ® MnO4 -.
30. Определите эквивалент и эквивалентную массу хрома в полуреакциях:
а) CrO2- ® CrO42-; б) Cr2O72- ® 2Cr3+.
ЗАКОН ЭКВИВАЛЕНТОВ
|
|
|


