 |
Основы органической химии.
|
|
|
|
Классическим примером цис-транс – изомерии является:
1) этановая - пропановая кислоты
2) пировиноградная – молочная кислоты
3) фумаровая – малеиновая кислоты
Энантиомеры - это изомеры, которые относятся друг к другу как:
1) предмет и транс – изомер
2) предмет и цис – изомер;
3) предмет и его зеркальное отображение.
Диастереомеры - это изомеры, которые:
1) относятся друг к другу как предмет и транс – изомер;
2) относятся друг к другу как предмет и цис – изомер;
3) не относятся друг к другу как предмет и его зеркальное
отображение.
Оптическими изомерами являются:
1) D- и L- молочная кислоты
2) фумаровая – малеиновая кислоты
3) пировиноградная – молочная кислоты.
Конформационная изомерия – это вид изомерии, который обусловлен способностью
атомов вращаться относительно:
1) двойной связи
2) углерод - углеродной σ – связи
3) углерод - водородной σ – связи
Индуктивный электронный эффект – это смещение электронной плотности к более
электроотрицательному атому:
1)по π – связи
2)по σ– связи
3)по δ– связи.
Мезомерный электронный эффект – это смещение электронной плотности к более
электроотрицательному атому:
1) по сопряженной системе
2) по δ – связи
3) по σ – связи.
15. Электронодонорные заместители:
1) уменьшают электронную плотность в системе;
2) не изменяют электронную плотность в системе;
3) увеличивают электронную плотность в системе.
Заместители, которые уменьшают электронную плотность в системе, называются:
электронодоноры
1)электроноакцепторы
2)протоноакцепторы.
В правиле Хюккеля значение n для молекулы нафталина равно
1) 1
2) 0
|
|
|
3) 5
4) 2
Пропантриол-1,2,3 образуется при гидролизе жиров. Его тривиальное название
1) холестерин
2) глицерин
3) метиловый спирт
4) карболовая кислота
Пропандиовая кислота образуется в организме при биосинтезе жирных кислот и тривиально называется следующим образом
1) малоновая
2) масляная
3) валериановая
4) капроновая
Бутандиовая кислота является компонентом цикла Кребса. Тривиальное название бутандиовой кислоты
1) янтарная
2) уксусная
3) масляная
4) капроновая
Как называется аминоуксусная кислота? Выберите тривиальное название
1) глиоксалевая кислота
2) глицин
3) глиоксаль
4) глицерин
Альфа-аминопропионовая кислота тривиально называется
1) валин
2) серин
3) аланин
4) глицин
Даже при небольших дозах этот спирт вызывает слепоту и смерть. Этот спирт называется
пропанол
1) метанол
2) этанол
3) пропантриол-1,2,3
Мочевина это
1) аминоуксусная кислота
2) полный амид угольной кислоты
3) этиламин
4) диамин
Глюкоза по международной заместительной номенклатуреназывается
1) 2,3,4,5,6-пентагидроксигексаналь
2) пентаналь
3) гексанал
4) 2,3-дигексаналь
Коламин по международной заместительной номенклатуре называется
1) 2-аминоэтанол-1
2) диаминоэтан
3) аминопропан
4) аминоэтанол
Примером гидрирования алкенов в организме человека является превращение:
1) пропеновая кислота → пропановая кислота;
2) этен → этан; 3) кротоновая кислота → масляная кислота.
Примером гидратации алкенов в организме человека является превращение:
1) кротоновая кислота → β – оксимасляная кислота;
2) пропеновая кислота → β – оксипропанова кислота;
3) этеновая кислота → этановая кислота.
Бромирование алкенов используется как качественная реакция на:
1) доброкачественность; 2)* ненасыщенность; 3) гомогенность.
В ароматическом кольце идут реакции по механизму:
|
|
|
1) электрофильного присоединения; 2) электрофильного замещения;
3) радикального замещения.
Электронодонорные заместители в аренах направляют второй заместитель в:
1) мета - или орто – положенния; 2) пара- или мета – положения;
3) орто- или пара – положения.
В организме человека в результате йодирования бензольного ядра образуется:
1) окситоцин; 2) тирозин; 3) тироксин.
В результате элиминированния гидроксисоединений в организме человека происходит такое превращение:
1) бутенова кислота → бутановая кислота;
2) яблочная кислота → фумаровая кислота;
3) лимонная кислота → изолимонная кислота.
Реакции в альдегидах идут по механизму:
1) нуклеофильного замещения 2) электрофильного присоединения;
3) нуклеофильного присоединения.
Примером восстановления альдегидов водородом в организме человека является:
1) восстановление ацетата до этанола;
2) восстановление глицеральдегида до глицерина;
3) восстановление сукцината.
Восстановление органических соединений в организме человека происходит с участием:
1) коферментов НАДН и убихинона; 2) белков; 3) моносахаридов.
Амиды – это производные карбоновых кислот, в которых:
1) оксо – группа замещена на NH2 – группу;
2) карбокси – группа замещена на NH2 – группу;
3) ОН- группа замещена на NH2 – группу.
Образование амидов в организме – это путь связывания из организма:
1) аминокислот; 2) аммиака; 3) аминов.
61. Доброкачественный препарат ацетилсалициловой кислоты:
1) дает фиолетовое окрашивание с FeCl3;
2) не дает фиолетового окрашивания с FeCl3;
3) дает фиолетовое окрашивание с бромной водой.
.Белки – это высокомолекулярные природные соединения, которые
являются:
1) конденсатами ß – аминокислот
2) полимерами α – аминокислот
3) конденсатами моносахаридов
Продуктами гидролиза сложных белков могут быть:
1) α– и β – аминокислоты
2) α– аминокислоты, моносахариды, липиды
3) только α– аминокислоты.
Тип связи между двумя радикалами цистеина в третичной структуре белка
1) дисульфидная связь
2) ковалентная
3) ионная
4) водородная
Смесь белков разделяют с помощью:
1) экстракции
2) *электрофореза
3) испарения
|
|
|
Тип связи лежит в основе первичной структуры белка
1) пептидная
2) гликозидная
3) дисульфидная
4) водородная
Высокоспецифическим методом разделения смеси белков является:
1) аффинная хроматография
2) хроматография на бумаге
3) адсорбционная хроматография
Денатурацию белков вызывают такие факторы:
1) радиация, ультрафиолет
2) 0,9%-ний раствор NaCl
3) бромная вода.
Изоэлектрическая точка белков – это:
1)давление раствора, в котором белки находятся в изоэлектрическом
состоянии
2) рН раствора, в котором белки находятся в изоэлектрическом
состоянии
3)температура раствора, в котором белки находятся в
изоэлектрическом состоянии
Качественной на пептиды и белки является реакция
1) биуретовая
2) серебряного зеркала
3) йодоформная
4) йодкрахмальная
Для пептидной связи характерна:
1) цикло – цепная таутомерия
2) цис – транс – изомерия
3) энантиомерия.
Пептидная связь между аминокислотами образуется за счет:
1)карбоксигруппы первой аминокислоты и аминогруппы второй
аминокислоты
2)аминогруппы первой аминокислоты и карбоксигруппы второй
аминокислоты;
3)между карбоксигруппами двух аминокислот.
Качественная реакция на пептидную связь:
1) ксантопротеиновая
2) с KMnO4
3) биуретовая
Первичная структура белка поддерживается:
1) ионными связями
2) пептидными связями;
3) силами Ван-дер-Ваальса.
N - концевую аминокислоту в пептидах определяют методом:
1) Кучерова
2) Эдмана
3) Марковникова
При мягком окислении молочной кислоты как in vivo так и in vitro образуется
1) ацетоксусная кислота
2) уксусная кислота
3) щавелевоуксусная кислота
4) пировиноградная кислота
Аспирин -это производное
1) пировиноградной кислоты
2) карболовой кислоты
3) салициловой кислоты
4) уксусной кислоты
Природные аминокислоты имеют только:
1) L – конфигурацию; 2) D – конфигурацию;
3) цис – конфигурацию.
Аминокислоты проявляют:
1) только кислотные свойства;
2) амфотерные свойства;
3) только основные свойства.
|
|
|
Изоэлектрическое состояние аминокислоты – это существование ее в
виде:
1) аниона;
2) биполярного иона;
3) катиона.
Для количественного определения аминокислот используют методы:
1) Ван – Слайка и Зеренсена;
2) Кучерова и Зелинского;
3) Эдмана и Сенджера.
Все аминокислоты дают фиолетовую окраску с:
1) бромной водой;
2) нингидрином;
3) хлоридом железа (III).
В результате окислительного дезаминирования аминокислот в
организме человека происходит превращение:
1) валин → уксусная кислота;
2) аланин → пировиноградная кислота;
3) аспарагиновая → масляная кислота.
Из аминокислоты гистидин в результате цепи превращений в организме
человека образуется:
1) серотонин;
2) ацетилхолин;
3) гистамин.
Редокс – системой в организме человека являются аминокислоты:
1) β – аланин – α – аланин;
2) фенилаланин – тирозин;
3) цистеин – цистин.
В результате декарбоксилирования триптофана в организме человека
образуется токсичный биогенный амин-алкалоид:
1) тиамин;
2) холин;
3) триптамин.
СПИСОК ЛИТЕРАТУРЫ
1. Попков, В.А.Общая химия /В.А.Попков. - Москва: ГЭОТАР-Медиа, 2009.-976 с.
2. Пузаков, С.А. Химия: учебник /С.А.Пузаков.-М.:ГЭОТАР-Медиа, 2006.-640с.
3. Слесарев, В.И. Химия: Основы химии живого/ В.И. Слесарев.-СПб: Химиздат, 2007. – 784 с.
4. Тюкавкина, Н.А. Биоорганическая химия/ Н.А Тюкавкина, Ю.И Бауков, С.Э. Зурабян.– М.: ГЭОТАР-Медиа, 2010.-358с.
Основные понятия и расчетные формулы в помощь для подготовки к зачёту
| Параметр | Обозначение, единица | Смысловое значение |
| Массовая доля вещества в растворе |  , доли , доли
 , проценты , проценты
| Отношение массы растворенного вещества к массе раствора |
 Моль Моль
|  n, моль
n, моль
| Количество вещества, которые содержит столько молекул (атомов) этого вещества, сколько атомов содержится в 12 г (0,012кг)  
|
| Количество вещества | n, моль

| Количество вещества равно отношению массы вещества к ее молярной массе |
| Молярная концентрация |  Моль\
Моль\  , моль\л , моль\л
| Отношение количества вещества X, содержащего в растворе, к объему раствора |
| Эквивалент | ____ | Это частица (условная или реальная), которая может отдавать, присоединять или как-то иначе быть равноценной одному иону водорода в кислотно-основных реакциях, а в ОВР – одному электрону |
| Фактор эквивалентности | 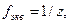 где z – число эквивалентов вещества, содержащегося в 1 моль этого вещества где z – число эквивалентов вещества, содержащегося в 1 моль этого вещества
| Число, показывающее, какая часть реальной частицы вещества эквивалента одному иону водорода в кислотно-основных реакции или одному электрону в ОВР |
| Количество вещества эквивалента | n(1/zX), моль

| Количество вещества, условной структурой которого является эквивалент |
| Молярная масса эквивалента вещества |  г/моль
г/моль
| Масса 1 моль эквивалента вещества |
| Молярная концентрация эквивалента |  Моль\
Моль\  , моль\л , моль\л
| Отношение количества вещества эквивалента в растворе к объему этого раствора |
| Молярная концентрация |  , моль/кг , моль/кг
| Отношение количества вещества к массе растворителя |
| Молярная доля вещества | 
| Отношение количества вещества компонента X к общему количеству всех веществ в системе |
| Титр раствора |  , г/мл , г/мл
| Масса вещества X, содержащегося в 1 мл раствора |
|
|
|
| Параметр | Обозначение, единица | Смысловое значение |
| Внутренняя энергия | U, кДж/моль | Полная энергия системы, равная сумме кинетической, потенциальной и других видов энергии всех частиц этой системы. Это функция состояния, приращение которой равно теплоте, полученной системой в изохорном процессе. |
| Работа | А, кДж/моль | Энергетическая мера направленных форм движения частиц в процессе взаимодействия системы с окружающей средой. |
| Теплота | Q, кДж/моль | Энергетическая мера хаотических форм движения частиц в процессе взаимодействия системы с окружающей средой. |
| Первый закон термодинамики | Q=∆U+A | Теплота, подведенная к закрытой системе, расходуется на увеличение внутренней энергии системы и на совершение системой работы против внешних сил окружающей среды. |
| Энтропия | S, Дж.(моль∙К) ∆S=Q/T, ∆S°r=∑v1S°(прод.р-ции)-∑v1(исх.в) | Функция состояния, характеризующая меру неупорядоченности системы, т.е. неоднородности расположения и движения её частиц, приращение которой равно теплоте, подведенной к системе в обратимом изотермическом процессе, деленной на абсолютную температуру, при которой осуществляется процесс. |
| Энтальпия | H, кДж/моль Н=U+pV ∆H=∆U+p∆V | Функция состояния, характеризующая энергетическое состояние системы в изобарных условиях. |
| Энтальпия реакции | ∆Hr, кДж/моль | Количество теплоты, которое выделяется или поглощается при проведении химических реакций в изобарных условиях. |
| Стандартное состояние | - | Наиболее устойчивая форма при заданной температуре (обычно 298 К) и давлении 1атм. |
| Стандартные условия | с.у. | Давление: 101 325 Па=1атм=760 мм рт.ст. Температура: 25⁰С≈298К. n(X в устойчивой модификации)=1 моль. |
| Стандартная энтальпия образования простых веществ | ∆H°f 298(вещество, агрегатное состояние), кДж/моль | При с.у. принимается равной нулю для простых веществ в их наиболее термодинамически устойчивом агрегатном и аллотропном состояниях. |
| Стандартная энтальпия образования сложных веществ | ∆H°f 298(вещество, агрегатное состояние), кДж/моль | Энтальпия реакции образования 1 моль этого вещества из простых веществ в с.у. |
| Стандартная энтальпия сгорания | ∆Hc (X), кДж/моль | Энтальпия сгорания (окисления) 1 моль вещества до высших оксидов в среде кислорода при с.у. |
| Энтальпия растворения | ∆H°r,кДж/моль
 , где
c-теплоемкость раствора , где
c-теплоемкость раствора
| Тепловой эффект растворения твердого вещества в изобарных условиях. |
| Энергия Гиббса | G, кДж/моль G=H-TS, ∆G°=∆Н-Т∆S, ∆G°r=∑vi∆G°i(прод.р-ции)-∑ vi∆G°i(исх.в-d) | Свободная энергия, обобщенная термодинамическая функция состояния системы, учитывающая энергетику и неупорядоченность системы в изобарных условиях. |
| Константа равновесия химической реакции для равновесия | Кравн, (моль/л)
Для реакции aA+bB=cC+dD

| Равна отношению произведения равновесных концентрация продуктов реакции к произведению равновесных концентраций реагентов в степенях, равных стехиометрическим коэффициентам. |
| Закон действующих масс для кинетики | ν=kС(A)aС(B)b | Скорость реакции пропорциональна произведению концентраций реагирующих веществ в степенях, которые называются порядками реакции по соответствующим веществам. |
| Порядок реакции по веществу | ni | Показатель степени, в которой входит концентрация реагента в уравнение для скорости химической реакции. Порядок может быть любой величиной: целой, дробной, положительной, нулем, отрицательной и даже переменной, зависящей от глубины протекания реакции. |
| Общий порядок реакции | n=nλ+nβ+… | Сумма порядков реакции по всем реагентам. |
| Средняя скорость реакции | 

| Усредненная скорость за данный промежуток времени |
| Истинная скорость реакции | 

| Характеризует скорость реакции в данный момент времени (∆τ→0) |
| Константа скорости реакции | k, c-1 – для реакций 1-го порядка; л/(моль∙с) – для реакций 2-го порядка | Индивидуальная характеристика реакции, численно равна скорости реакции при концентрациях реагентов, равных 1 моль/л. |
| Энергия активации | Еа, кДж/моль | Минимальная избыточная энергия взаимодействующих частиц, достаточная для того, чтобы эти частицы вступили в химическую реакцию. |
| Период полупревращения | τ1/2, с, мин, ч, сут | Время, за которое концентрация реагирующего вещества уменьшается вдвое. |
| Период полураспада | τ1/2, с, мин, ч, сут | Время, за которое количество радиоактивного уменьшается в 2 раза. |
| Правило Вант-Гоффа | 
 где
где  - температурный коэффициент скорости реакции; - температурный коэффициент скорости реакции;
 и и  – скорости реакции при температуре Т1 и Т2 соответственно – скорости реакции при температуре Т1 и Т2 соответственно
| С увеличением температуры на каждые 10 градусов скорость химической реакции возрастает в 2-4 раза. (Для биохимических реакций γ достигает значений 7-9). |
| Уравнение Аррениуса |  Где
Где  - константа скорости реакции; А- предэкспоненциальный множитель; Е – энергия активации - константа скорости реакции; А- предэкспоненциальный множитель; Е – энергия активации




| Устанавливает связь между константой скорости реакции, энергией активации и температурой. |
| Параметр | Обозначение, единица | Смысловое значение |
| Осмотическое давление | pосм, π, кПа π =СRT, π= i СRT | Избыточное гидростатическое давление, возникающее в результате осмоса и приводящее к выравниванию скоростей взаимного проникновения молекул растворителя через мембрану с избирательной проницаемостью |
| Изотонический коэфициент | i; i=1 + α(ν – 1), где ν — число ионов на которое распадается данный электролит; α — степень диссоциации | Отношение общего числа частиц (молекул и ионов) растворенного вещества в растворе после диссоциации к исходному числу молекул вещества, учитывает межмолекулярные взаимодействия в реальных растворах |
| Осмолярная концентрация | С осм = i С(X), осмоль\л | Суммарное молярное количество всех кинетически активных частиц, содержащихся в 1 л раствора, независимо от их формы, размера и природы |
| Онкотическое давление | π онк, Па | Осмотическое давление, создаваемое за счет наличия белков в биологических жидкостях организма |
| Давление насыщенного пара | p, кПа | Давление пара, при котором при данной температуре в системе жидкость — пар наступает динамическое равновесие νисп = vконд |
| Относительное понижение давления насыщенного пара растворителя над идеальным, или бесконечно разбавленным, раствором нелетучего вещества | 
| При постоянной температуре равно молярной доле растворенного вещества (первый закон Рауля) |
| Температура кипения жидкости | Т кип | При данной температуре давление насыщенного пар над жидкостью становиться равным внешнему давлению |
| Температура замерзания жидкости (появление первых кристаллов растворителя) | Т зам | При данной температуре давление насыщенного пара над жидкостью становиться равным давлению насыщенного пара над кристаллами этой жидкости |
| Повышение температуры кипения или понижение температуры замерзания идеальных, или бесконечно разбавленных, растворов нелетучих веществ | Δt кип = KэбС m (X) Δt зам = K кр C m (X) Δt кип = i K эб С m (X) Δt зам = i К кр С m (X) (i вводится в формулу для растворов электролитов) | Прямо пропорционально моляльной концентрации вещества Х в растворе (второй закон Рауля) |
| Эбулиоскопическая и криоскопическая константы | K эб К кр | Численно равны повышению температуры кипения или, соответственно, понижению температуры замерзания одномоляльного идеального раствора (1 моль вещества в 1000г растворителя) нелетучего вещества по сравнению с чистым растворителем |
| Константа диссоциации (ионизации) | Ка= [H+][ A-] (1) [HA] Кb= [BH+][ OH-] (2) [B] | Константа равновесия процесса диссоциации. Для кислоты HA, ионизация которой в воде, дает H3O+ и A-, константа Ка выражается уравнением (1). Для основания B, при ионизации которого, образуются анион OH - и протонированное основание BH +, константа Кb выражается уравнением (2) |
| Степень диссоциации |
 где Ci— концентрация молекул распавшихся на ионы;
Co — общая концентрация растворенных молекул
где Ci— концентрация молекул распавшихся на ионы;
Co — общая концентрация растворенных молекул
 где i — изотонический коэффициент
v— число ионов на которое распадается данный электролит
где i — изотонический коэффициент
v— число ионов на которое распадается данный электролит
| Отношение числа продиссоциированных молекул к общему числу молекул электролита, введенных в раствор. Величина безразмерная. Степень диссоциации возрастает при разбавлении раствора, при повешении температуры раствора |
| Закон разведения Оствальда |
  при
при 
| С уменьшением концентрации раствора степень диссоциации слабого электролита увеличивается |
| Активность иона | a(X i), моль/л a(Xi) = γ (X i)Ci (X i) | Эффективная концентрация иона (Xi), соответственно которой он учавствует во взаимодействиях, протекающих в растворах сильных электролитов |
| Коэффициент активности иона | γ | Показывает, во сколько раз активность иона отличается от его истинной концентрации в растворе сильного электролита |
| Ионная сила раствора |  моль/л моль/л
| Характеризует интенсивность электростатического поля всех ионов в растворе. |
| Ионное произведение воды | K w= [H +][OH-]=const [H + ][OH-]=1·10-14 (при Т=298 К) | Величина постоянная при данной температуре для воды и любых водных растворов, равная произведению концентрации ионов водорода и гидроксид ионов |
| Водородный показатель | pH= -lg [H+ ] pH= -lg a[H+ ] pH= -lg (γС(H +)) | Количественная характеристика щелочности среды, равная отрицательному десятичному логарифму концентрации свободных ионов Н+ в растворе. |
| Гидроксильный показатель рОН | pOH= -lg [ OH-] pOH + pH=14 (при 25о С) | Количественная характеристика щелочности среды, равная отрицательному десятичному логарифму концентрации свободных ионов ОН- в растворе. |
| Активная кислотность | pH | Концентрация свободных ионов водорода, имеющихся в растворе при данных условиях. Мерой активной кислотности является значение рН раствора |
| Параметры | Обозначения, единица измерения | Смысловые значения |
| Активная кислотность в растворах сильных кислот. | [H+]акт = γ(H+)С(1/zслабой кислоты) где γ(H+) - коэффициент активности катиона водорода | Зависит от концентрации кислоты и межионного взаимодействия |
| Активная кислотность в растворах слабых кислот. | [H+]акт =  pH =½pK – ½lgС(1/zслаб. к-ты)
pH =½pK – ½lgС(1/zслаб. к-ты)
| Слабые кислоты присутствуют в растворах в ионизированной и молекулярной формах. Активная кислота зависит от природы и концентрации слабого электролита |
| Потенциальная (резервная) кислотность | [H+]пот. = 
| Равна суммарной молярной концентрации эквивалентов слабых кислот. |
| Общая кислотность |  [H+]общ =[H+]акт + [H+]пот [H+]общ =[H+]акт + [H+]пот
| Равна сумме молярных концентраций эквивалентов сильных и слабых кислот, содержащихся в растворе. Это общая аналитическая концентрация кислоты, которая устанавливается титрованием |
| рН кислотной буферной системы |  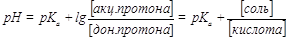
| Кислотный буферный раствор содержит слабую кислоту(донор Н+) и соль этой кислоты (акцептор Н+) |
| рН основной буферной системы | 
| Основный буферный раствор содержит слабое основание (акцептор протона) и соль этого основания (донор протона) |
| Буферная емкость по кислоте | 
| Число моль-эквивалентов сильной кислоты, которое нужно добавить к одному литру буферного раствора, чтобы изменить величину pH на единицу |
| Буферная емкость по основанию | 
| Число моль-эквивалентов щелочи, которое нужно добавить к одному литру буферного раствора, чтобы изменить величину pH на единицу |
| Константа растворимости |  Для электролита Ktn Anm
Ks = [Ktm+ ]n [Ann-]m
Для электролита Ktn Anm
Ks = [Ktm+ ]n [Ann-]m
| Произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при данных условиях |
| Координационное число | k.ч. | Число свободных атомных орбиталей, предоставляемых комплексообразователем, т. е. Число связей комплексообразователя и лиганда |
| Дентатность лиганда | Число электронных пар, предоставляемых лигандом, для образования донорно-акцепторной связи с комплексообразователем |
| Параметры | Обозначения, единица измерения | Смысловые значения |
| Параметр | Обозначение, единица | Смысловое значение |
| Свободная поверхностная энергия | Gs, Дж Gs=σS Gs→min | Термодинамическая функция, характеризующая энергию межмолекулярного взаимодействия частиц на поверхности раздела фаз с частицами каждой из контактирующих фаз. |
| Изотермы адсорбции | Г = Г∞ +  , (1)
где Г – величина адсорбции;- предельная адсорбция; с – равновесная концентрация адсорбата; а –константа адсорбционного равновесия
Г = k ·c1/n, (2) если n > 1,
Г = k ·cn, если n < 1,
где k и n – эмпирические константы Фрейндлиха , (1)
где Г – величина адсорбции;- предельная адсорбция; с – равновесная концентрация адсорбата; а –константа адсорбционного равновесия
Г = k ·c1/n, (2) если n > 1,
Г = k ·cn, если n < 1,
где k и n – эмпирические константы Фрейндлиха
| Зависимость между величиной адсорбции концентрацией раствора при достижении адсорбционного равновесия в условиях постоянной температуры, выражаются уравнениями Ленгмюра (1) и Фрейндлиха (2). При адсорбции газов и паров вместо концентрации (с) в уравнениях используют парциальное давление газа или пара. |
| Мицелла лиофобной системы | {mAgI · nI- ·(n – x)K+}x-·xK+
 Ядро Ядро
 гранула гранула
 мицелла
мицелла
| Состоит из микрокристалла дисперсной фазы, окруженного сольватированными ионами стабилизатора. |
| Межфазный потенциал | Потенциал ДЭС на границе раздела между твердой и жидкой фазами в мицелле. | |
| Электрокинетический потенциал | ξ –потенциал (дзета-потенциал) | Потенциал на границе скольжения между адсорбционной и диффузной частями ДЭС мицеллы. |
| Порог коагуляции | спк =  ,
где сэл исходная концентрация раствора электролита; Vэл -объем раствора электролита, добавленного к коллоидному раствору; Vкол.р-ра- объем коллоидного раствора. ,
где сэл исходная концентрация раствора электролита; Vэл -объем раствора электролита, добавленного к коллоидному раствору; Vкол.р-ра- объем коллоидного раствора.
| Минимальное количество электролита, вызывающего явную коагуляцию раствора. |
| Правило Шульца-Гарди | спк =  γ =
γ =  γ ~ z6
где z – заряд коагулирующего иона;
γ ~ z6
где z – заряд коагулирующего иона;  - коагулирующая способность электролита. - коагулирующая способность электролита.
| Коагуляцию вызывают ионы, имеющие заряд, противоположный заряду гранулы коллоидной частицы; коагулирующее действие ионов-коагулянтов возрастает с увеличением их заряда. |
| Вязкость раствора | η, Па · с | Свойство жидкостей оказывать сопротивление перемещению одной их части относительно другой при различных видах деформации. |
| Набухание ВМС | α =  α =
α =  где m0- начальная масса; V0- начальный объем образца ВМС; m и V масса и объем набухшего образца ВМС.
где m0- начальная масса; V0- начальный объем образца ВМС; m и V масса и объем набухшего образца ВМС.
| Процесс проникновения растворителя в полимерное вещество, сопровождаемый увеличением объема и массы образца, количественно характеризуется степенью набухания (α). |
| Осмотическое давление растворов ВМС | Уравнение Галлера
Росм =  + в·с2,
где с – массовая концентрация ВМС в растворе (г/л, кг/м3); М – средняя молярная масса ВМС; β - коэффициент, учитывающий гибкость и форму макромолелекул. + в·с2,
где с – массовая концентрация ВМС в растворе (г/л, кг/м3); М – средняя молярная масса ВМС; β - коэффициент, учитывающий гибкость и форму макромолелекул.
| Экспериментально определенное осмотическое давление для раствора ВМС заданной концентрации значительно превышает вычисленное по закону Ван-Гоффа, что связанно с размером и гибкостью цепей макромолекул, которые ведут себя в растворе как несколько более короткий молекул. |
| Онкотическое давление крови | πонк, (2,5-4,0 кПа в норме) | Осмотическое давление, создаваемое за счет наличия белков в биологических жидкостях организма. |
| Изоэлектрическая точка ВМС | pI | Значение рН, при котором молекула ВМС имеет суммарный заряд, равный 0,и поэтому при электрофорезе не движется ни к аноду, ни к катоду. |
| Уравнение Марка-Хаувинка | [  ] = ] = 

 где M - средняя молекулярная масса ВМС; k – коэффициент постоянный для раствора ВМС одного гомологического ряда в данном растворителе; α – коэффициент, характеризующий гибкость цепей макромолекул в растворителе и их форму в зависимости от конформации.
где M - средняя молекулярная масса ВМС; k – коэффициент постоянный для раствора ВМС одного гомологического ряда в данном растворителе; α – коэффициент, характеризующий гибкость цепей макромолекул в растворителе и их форму в зависимости от конформации.
| Устанавливается связь между характеристической вязкостью и молекулярной массой ВМС. |
|
|
|


