 |
Электроэнцефалография (ЭЭГ)
|
|
|
|
ЭЭГ — показана при проведении дифференциальной диагностики между психическими расстройствами органического происхождения и психиатрическими синдромами, уточнении места расстройства при фокальных нарушениях головного мозга.
ЭЭГ обычно назначают больным с первичным психотическим эпизодом или больным с указанием в анамнезе на черепно-мозговую травму, пароксизмально возникающие психические нарушения со стереотипно повторяющейся симптоматикой, неврологические расстройства (нарушения сознания, нейроинфекции, осложнения в перинатальном периоде, судорожные приступы, сосудистые мозговые кризы).
Информативность ЭЭГ ограничена при ЭСТ и применении психотропных средств, которые влияют на результаты ЭЭГ, затрудняя ее расшифровку. Нормальная картина ЭЭГ не обязательно означает отсутствие органического заболевания или эпилепсии.
Пароксизмальная активность при выборочном проведении ЭЭГ может не возникать даже при имеющемся эпилептическом очаге, в этих случаях целесообразно проведение ЭЭГ в состоянии депривации сна или 24-часовой мониторинг. У психически больных отмечается повышенная чувствительность к различным методам стимуляции при проведении ЭЭГ, таким как депривация сна, провокация световыми стимулами гипервентиляции.
Реоэнцефалография (РЭГ)
РЭГ показана для исключения сосудистых поражений мозга. В динамике РЭГ волны различают начало (1), крутой подъем (2), вершину (3), позднюю систолическую волну (4), инцизуру (5), дикторический зубец (6). Фазы 1—4 составляют систолическую фазу, а 5— 6—1 — диастолическую. Сглаженность волн на уровне 2—4 и 5—1 указывает на нарушение кровоснабжения в соответствующем полушарии. Более точные сведения о состоянии сосудов мозга можно получить только на основе допплерографии.
|
|
|
Эхоскопия
Эхоскопия используется только для оценки смещения срединных структур мозга при подозрении на опухоль или атрофический процесс, а также для выявления расширения желудочков мозга.
Компьютерная томография (КТ)
Рекомендуется для исключения возможных органических изменений центральной нервной системы, которые могут лежать в основе психического расстройства или видоизменять его. Она проводится в следующих случаях:
— при первичном эпизоде психотического расстройства в возрасте после 40 лет,
— появления патологических движений,
— делирия или состояния слабоумия неясной этиологии,
— продолжительного кататонического состояния,
— нервной анорексии.
Абсолютные показания:
— наличие очаговой симптоматики и/или морфологических повреждений, обнаруживаемых при неконтрастном исследовании,
— больным, у которых в анамнезе есть указания на черепно-мозговую травму, субарахноидальную гематому.
У больных шизофренией на КТ отмечается:
— реверсивная церебральная асимметрия и корковая атрофия,
— мозжечковая атрофия, расширение третьего желудочка и высокий показатель соотношения объема желудочков к объему мозга у больных с длительным течением,
— наблюдается также обратная зависимость между расширением желудочков и качеством реакции на проводимое лечение нейролептиками.
Магнитно-резонансное исследование (МРТ)
МРТ использует магнитное поле для определения частоты резонанса составляющих химического элемента в различных тканях тела.
Большое значение имеет данное исследование в диагностике первичных атрофических деменций (Альцгеймера, Пика).
Преимущества МРТ перед КТ — изображение во всех плоскостях, включая сагиттальную, венечную, дополнительно к поперечному срезу; более высокая разрешающая способность при изображении структуры ткани; лучшее различение белого и серого вещества мозга; повреждения при демиелинизирующих заболеваниях (рассеянный склероз) видны более четко; отличное изображение гипофизарной области и задней черепной ямки.
|
|
|
Позитронно-эмиссионная томография (ПЭТ)
Обеспечивает изображение функционального состояния мозга и является особенно многообещающим методом при исследовании нейротрансмиттерных систем. Вещество, излучающее позитроны (флуорин-18, карбон-14) включается в биологическое соединение (например, Д-глюкозу), которое затем вводится внутривенно, затем картируется распределение этого вещества в разных отделах мозга. С помощью этого метода изучены:
— уменьшение префронтального метаболизма при шизофрении,
— увеличение уровня метаболизма в базальных ганглиях и орбитальных зонах коры лобных долей у больных обсессивно-компульсивными расстройствами,
— блокада нейролептиками D2 рецепторов у больных шизофренией.
Лабораторные исследования.
Нейромедиаторные системы.
В синапсах происходят процессы передачи нервных импульсов с помощью нейромедиаторов (нейрогормонов), накапливающихся в синаптических пузырьках, высвобождающихся при нейрональной передаче в синаптическую щель и присоединяющихся к специфическим рецепторам постсинаптической мембраны (то есть к таким участкам, к которым они «подходят, как ключ к замку»). В результате изменения проницаемости постсинаптической мембраны сигнал передается с одного нейрона на другой. Медиаторы могут блокировать передачу нервных сигналов на уровне синапса, уменьшая возбудимость постсинаптического нейрона. Дезактивация нейромедиатора проходит двумя способами: ферментацией (разрушением ферментами) и обратным поглощением в пресинаптическое окончание. Это приводит к восстановлению их запаса в пузырьках к моменту прихода следующего импульса.
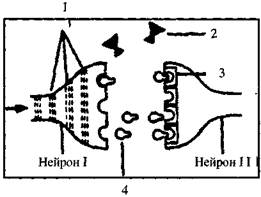
1 — нервные импульсы, 2 — молекулы X вещества, 3 — участки рецепторов, 4 — молекулы нейромедиатора
Молекулы нейромедиатора высвобождаются из концевой бляшки нейрона I, связываются со специфическими рецепторами на дендритах нейрона II. Молекулы Х-вещества по своей конфигурации не подходят к этим рецепторам и не вызывают каких-либо синаптических эффектов.
|
|
|
Возбуждающая или тормозная функция синапса зависит от типа выделяемого им медиатора и от действия последнего на постсинаптическую мембрану. Некоторые нейромедиаторы оказывают только возбуждающее действие, другие — только тормозное (ингибирующее), третьи в одних отделах нервной системы играют роль активаторов, а в других — ингибиторов.
Функции нейромедиаторов. В настоящее время известно несколько десятков нейромедиаторов, но их функции изучены пока недостаточно.
Ацетилхолин
Из всех нейромедиаторов одним из первых был открыт ацетилхолин. Он содержится в местах соединения нейронов с мышечными клетками, участвует в мышечном сокращении, вызывает замедление сердечного и дыхательного ритма. Инактивируется ферментом ацетилхолинэстеразой. Ацетилхолин играет важную роль в деятельности мозга, но подобно большинству других нейромедиаторов его функции до конца не изучены. Известно, что он является важным регулятором ощущения жажды. Предположительно, ацетилхолин также является важным элементом системы памяти. Болезнь Альцгеймера связана с нарушением функционирования ацетилхолина и холинергических рецепторов в ядрах промежуточного мозга.
Моноамины
Моноаминами называются три важных нейромедиатора, входящих в одну аминогруппу, — норепинефрин (норадреналин), дофамин и серотонин.
Норадреналин
Отвечает за бодрствование мозговой коры, регулирует физические изменения, сопровождающие эмоциональный подъем, чувство голода и учащение сердечного ритма. Эмоциональное состояние тревоги, перерастающей в страх, связывают с нарушением обмена норадреналина.
Серотонин
Находится во всех частях мозга, играет важную роль в регулировании сна, определяет объем информации, циркулирующей в сенсорных путях. Состояние тоски связывается с нарушением обмена серотонина.
Дофамин
Участвует в процессах избирательного внимания, согласованных движениях частей тела, присутствует в «центрах удовольствия» лимбической системы и некоторых ядрах ретикулярной формации. Недостаток дофамина в скорлупе и ядрах шва (базальные ядра) может быть главной причиной болезни Паркинсона. Нарушения дофаминового обмена составляют биохимическую основу возникновения шизофрении. Наркотики-стимуляторы, такие как кокаин и амфетамины, усиливают дофаминергическую активность мозга.
|
|
|
Кроме указанных функций, моноамины тесно связаны с настроением и эмоциональными расстройствами. Клиническая депрессия возникает из-за изменения уровня моноаминов, в особенности норадреналина и серотонина.
Частичная инактивация моноаминов происходит в результате их окисления ферментом моноаминоксидазой. Этот процесс возвращает активность мозга к нормальному уровню.
|
|
|


